双热点机制结合。5+铜死亡+铁死亡相关基因生信思路
今天给同学们分享一篇结合铜死亡和铁死亡相关基因预测肿瘤预后、免疫和药敏的生信文章“A novel signature of combing cuproptosis- with ferroptosis-related genes for prediction of prognosis, immunologic therapy responses and drug sensitivity in hepatocellular carcinoma”,这篇文章于2022年9月27日发表在Front Oncol期刊上,影响因子为5.738。作者的研究旨在构建一个结合铜死亡相关基因和铁死亡相关基因的新特征(CRF),用于预测肝细胞癌(HCC)患者的预后、免疫治疗反应和药物敏感性。

图1 总体研究设计流程图
1.结合铜死亡和铁死亡相关基因特征的构建
共发现122个FAG与12个CRG密切相关(图2A)。此外,作者在这134个基因中筛选了40个差异表达基因(图2B)。此外,作者通过单因素Cox回归分析从这40个基因中获得了26个候选基因(图2C、D)。此外,这些候选基因被输入到LASSO算法中,并选择了7个基因(G6PD、NRAS、RRM2、SQSTM1、SRXN1、TXNRD1和ZFP69B)用于构建CRF(图2E、F)。它提到根据来自ICGC、GSE76427、GSE144269和CCLE数据库的数据,构成CRF的七个基因在HCC组织中高度表达(图2G-J)。

图2 在TCGA中构建预后特征(CRF)
根据TCGA队列中HCC患者的风险评分,并根据中位风险评分将HCC患者分为高风险组和低风险组。作者发现,风险评分较高的患者显示出较短的OS和较高的死亡率(图3A)。PCA和t-NSE表明低风险和高风险组中的HCC患者明显聚集(图3B、C)。如图3D、E所示,CRF是HCC患者OS的有前途的预测指标。此外,KM曲线显示高危组患者预后较差(图3G-I)。值得注意的是,这项研究表明CRF在预测HCC患者的预后方面优于TNM分期(图3F)。单因素Cox回归分析表明,CRF是HCC患者OS的危险因素(图3J),多因素Cox回归分析显示CRF是HCC患者OS的独立危险因素(图3K)。

图3 评估TCGA中的预后特征(CRF)
2. 结合铜死亡与铁死亡相关基因特征的验证
同样,ICGC队列中的患者根据中位风险评分被分配到低风险组和高风险组。如图4A-I所示,在ICGC队列中通过CRF评估HCC预后的结果与TCGA队列中的结果几乎一致。此外,CRF在预测GSE144269队列中HCC患者的预后方面也表现出色。因此,这些发现表明CRF在预测HCC的预后方面显示出巨大潜力。
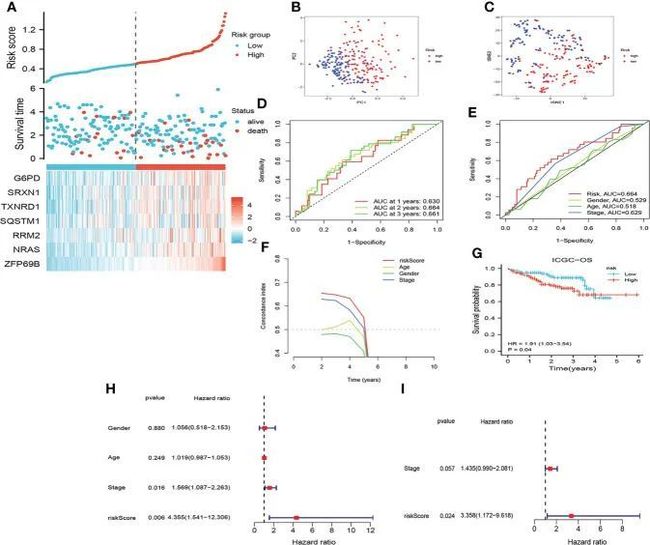
图4 评估ICGC中的预后特征(CRF)
3. 结合铜死亡和铁死亡相关基因特征与临床病理参数的相关性
较高的风险评分集中在这些具有晚期TNM分期、T分期和分级的患者中(图5A、B、D、E、G、H)。此外,在这些具有肿瘤状态和血管侵犯特征的患者中也观察到相对较高的风险评分(图5A、C、F)。这表明较高的风险评分代表较差的预后,并验证了CRF在预测HCC预后方面的巨大潜力。

图5 风险评分与临床指标的相关性
4. 将铜死亡与铁死亡相关基因特征与其他有希望的基因特征相结合的比较
如图6所示,与这些涉及铜死亡、细胞焦亡、炎症反应、铁死亡和代谢相关基因特征的研究相比,CRF在预测HCC患者的预后方面表现更佳。具有重要意义的是,作者的研究进一步验证了CRF在评估HCCOS方面的强大预测能力。

图6 CRF与其他基因特征的比较
5. 基于铜死亡和铁死亡相关基因特征的列线图的构建
为了在临床实践中更好地应用CRF,作者根据TCGA队列中的风险评分、性别、TNM分期和年龄创建了列线图(图7A)。如图7B所示,预测HCC患者1年、3年和5年生存率的AUC值分别为0.799、0.733和0.722,而c指数和DCA曲线显示诺模图与风险评分和TNM分期相比可能更可以准确预测HCC患者的预后(图7C、E)。此外,校准曲线表明,1年、3年和5年生存率的预测概率与实际值高度一致(图7D)。根据列线图总分的中位数,将患者分别分为高危组和低危组。此外,列线图可以区分高风险和低风险患者,高风险组患者的OS更差(图7F、G)。这些结果表明列线图在预测HCC患者的OS方面具有极好的潜力。

图7 基于CRF、性别和分期的列线图
6. 结合铜死亡和铁死亡相关基因特征在预测免疫疗法和其他疗法的反应中的作用
高风险和低风险人群的免疫状态存在显着差异。低风险组患者表现出更大比例的巨噬细胞和NK细胞,而高风险组患者表现出更多的Th2和Treg细胞(图8A、C、D)。在免疫功能方面,I型IFN反应和II型IFN反应在低风险组中显着增强,而免疫检查点和副炎症在高风险组中上调(图8B)。作者发现高风险组的患者似乎有明显的免疫抑制状态。免疫检查点基因的表达实际上在高危组中被上调(图8E),并且风险评分与一些有前途的免疫检查点基因的表达显着正相关,例如CTLA4、PDCD1和CD274。
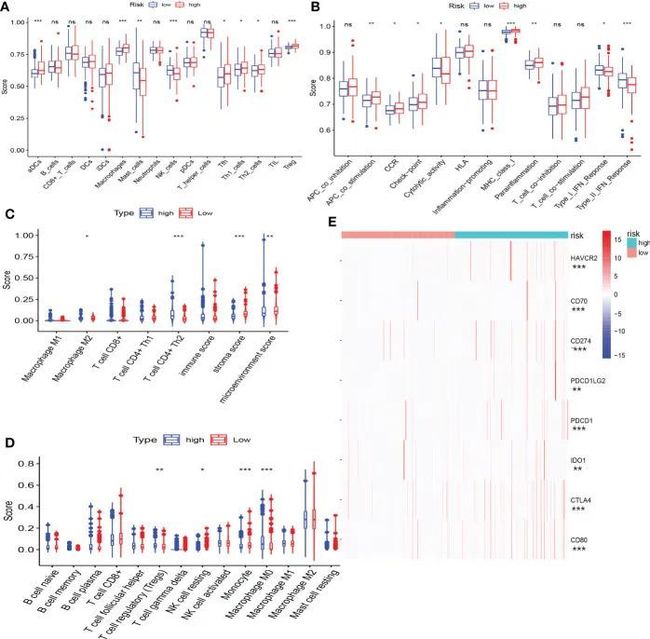
图8 CRF与免疫特征之间的相关性
7. 结合铜死亡与铁死亡相关的基因特征来预测对免疫治疗的反应
如图9A所示,免疫治疗的反应者呈现较低的TIDE分数。非常重要的是,高危组患者可能更有可能对免疫治疗产生反应(图9B、C)。此外,免疫表型评分确定低风险组患者对PD-1和CTLA-4的治疗不敏感(图9D)。此外,高危组患者的TIS评分更高(P<0.05)(图9E)。CD8A和STAT1的上调表达集中在高危组中(图9G、H)。正如预期的那样,在IMvigor210队列中,这些免疫疗法应答者的风险评分升高(图9F)。作者的结果表明,高危人群的患者可能更有可能从免疫治疗中获益。

图9 免疫治疗的反应
8. 铜死亡和铁死亡相关基因的药敏分析和药物预测
如图10A所示,对TACE治疗有反应的患者呈现出较低的风险评分(p<0.01)。此外,评估TACE反应的风险评分的AUC为0.658(AUC值>0.65)(图10B)。这些结果初步表明,CRF可作为一种新型生物标志物用于评估TACE治疗HCC患者的疗效。作者从总共300多种药物中选择了5种药物,其中MG-132、PHA-665752、雷帕霉素和舒尼替尼更适合高危组患者,而厄洛替尼可能更有益于低危组患者(P<0.001)(图10C)。更重要的是,作者还获得了风险评分和药物敏感性之间的相关系数(图10D),作者从中证明了舒尼替尼可能最适合高危患者。

图10 CRF在药物敏感性的反应中的作用
9. mRNAsi分析和突变分析
如图11A、B所示,高危组患者mRNAsi比例较高,风险评分与mRNAsi呈正相关。这些发现可能从mRNAsi的角度解释了高危组患者预后不良的主要机制之一。根据瀑布图,作者发现TP53突变在高风险组中更常见,而CTNNB1突变在低风险组中更常见(图11C、D)。高风险组患者的突变频率高于低风险组患者。此外,错义突变是两个亚组中最常见的突变类型。如图11E所示,高风险组的TMB明显大于低风险组。此外,高TMB组患者的OS不如低TMB患者(图11F)。值得一提的是,当TMB与风险评分相结合时,TMB可能在预测OS方面表现更好(图11G)。
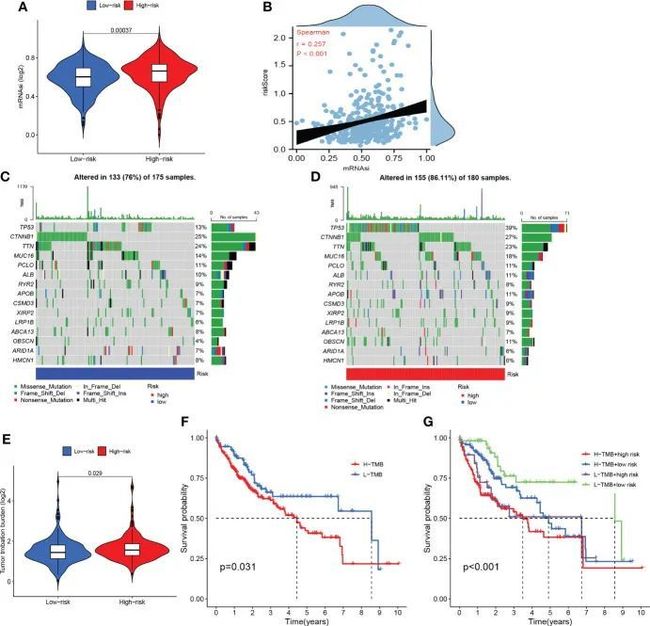
图11 干性分析和突变分析
10. 功能富集分析
高风险组和低风险组之间的DEGs通过火山图可视化(图12A)。如图12B、C所示,这些基因的功能主要集中在细胞器裂变、核分裂和染色体分离中。GSEA显示,许多癌症转移途径在高危人群中显着丰富,例如细胞粘附分子(CAM)、细胞因子-受体相互作用、细胞周期和癌症途径(图12E)。有趣的是,造血细胞谱系相关通路在高危人群中也显着丰富。此外,一些代谢通路在低危组中富集,如脂肪酸、甘氨酸丝氨酸、苏氨酸代谢和药物代谢P450相关通路(图12D)。

图12 富集分析
总结
总之,作者的研究基于七个与铜死亡相关的铁死亡基因定义了一个新的基因特征,并证明CRF在预测HCC患者的预后方面表现出色。值得注意的是,高风险组患者更有可能对免疫治疗产生反应,而低风险组患者可能受益于TACE。基于CRF,舒尼替尼被证明更适合高危患者。因此,CRF有望作为预后、免疫治疗、TACE治疗和药物敏感性的新型生物标志物。