文献解读 | 单细胞转录组图谱揭示了茶叶中儿茶素酯的发育轨迹和新的代谢途径
题 目:Single-cell transcriptome atlas reveals developmental trajectories and a novel metabolic pathway of catechin esters in tea leaves
发表日期:2022年7月
发表期刊:Plant Biotechnology Journal
影响因子:13.263
实验方法:10xGenomics、LC-MS、Bulk RNA-seq
研究背景
茶树叶片用于生产多种茶,提供了大量的次级代谢产物,带来丰富的口感和健康益处。茶树叶片的发育伴随着次生代谢物的规律变化,包括茶特有的化合物,如多酚、咖啡因和茶氨酸。尽管植物次生代谢与发育和环境密切相关,并且它们在器官和组织水平上的关系已被广泛研究,但它们在不同类型细胞中的生物合成和分布很少有报道。
单细胞RNA测序(scRNA-Seq)的进展现在使得用少量起始材料对稀有细胞的转录组测序成为可能。基于scRNA-seq能够在单细胞水平上监测细胞内转录活性的技术,作者通过原生质体分离、单细胞测序和细胞特异性组织分离构建了第一个木本茶树单细胞水平图谱。此外,还鉴定了每个细胞簇和茶叶细胞类型的特定标记基因。首次在体外和体内鉴定出一种尿苷二磷酸依赖性糖基转移酶(UGT),该酶参与儿茶素酯的糖基化,揭示了对植物中儿茶素酯代谢的复杂发育调控的见解。
技术路线
研究结果
1、茶叶结构与细胞类型鉴定
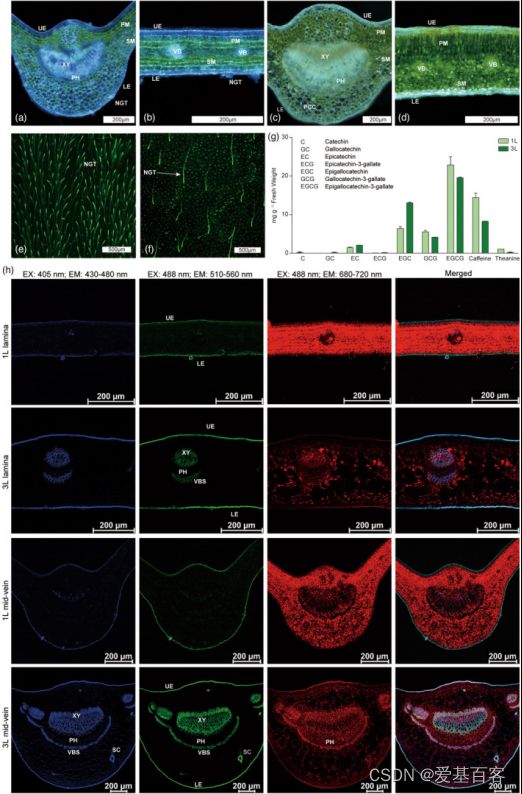
为辅助scRNA-Seq的细胞类型,作者用不同方法进行了茶树叶片的切片。在显微镜下观察茶叶主脉的横切切片,显示上表皮(UE)细胞(表皮铺装细胞,图1a–d)和下表皮(LE)细胞(图1 e,f)、叶肉细胞(栅栏(PM)和海绵状叶肉(SM)细胞,见图1a–d);维管束(VB)细胞(包括木质部(XY)、韧皮部(PH)、维管束鞘、薄壁组织细胞(PCC)和石细胞,图1a-d)。其中只有下表皮有气孔和腺毛。1 L(第1叶片)的腺毛密度和气孔密度分别较高和较低, 3 L(第3叶片)情况相反(图1e,f)。1L的茶氨酸、儿茶素(GCG和EGCG)和咖啡因含量高于3L(图1g)。切片观察为细胞类型鉴定提供了许多直观的依据。毛细胞和石细胞将被40ul筛过滤并去除(图1h,S1b)。表皮细胞和成熟木质部细胞很少有绿色叶绿体,但叶肉细胞有许多叶绿体,并呈深绿色(图1a–d)。木质部细胞、维管束鞘细胞和表皮细胞都有增厚的细胞壁,富含木质素(图1h)。
图1 茶树第1叶和第3叶的细胞特征
2、原生质体快速分离和单细胞转录组测序
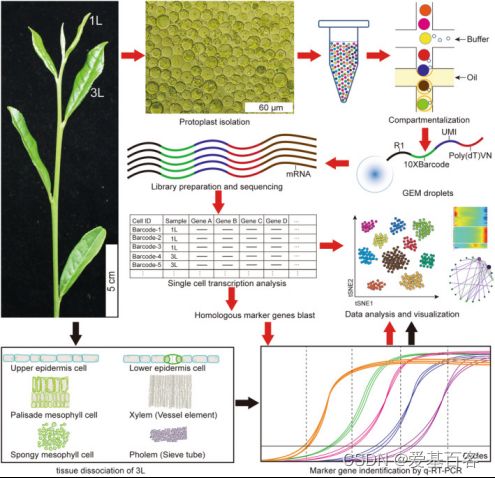
为减少原生质体处理的影响,作者添加了蜗牛酶,将消化时间从16小时缩短至4–6小时。每个样品的活细胞比率为73%-82%。显微镜检查显示丰富的细胞类型(图2)。将分离的原生质体用10xGenomics平台进行scRNA-seq分析(图2)。共捕获了18395个细胞,检测到每个细胞的基因中位数1476(1L)和1696(3L),以及UMI中位数2530(1 L)和3568(3 L)。
图2.茶树嫩叶scRNA-seq的简要流程图
3、茶叶细胞图谱的绘制
基于横截面观察的结果,作者绘制了茶叶的结构,为帮助识别细胞类型簇(图3a)。通比对分析后,共有16 977个细胞被划分为16个转录上不同的细胞簇(图3b)。细胞簇2、4和7仅在1L中发现,而5和10亚群在3L中发现(图3b)。为揭示细胞群体的局部相似性和整体结构,使用tSNE揭示簇、样本和细胞类型(图3c)。然后,根据公布的Bulk RNA-seq筛选出原生质体响应基因。6小时的消化影响了730多个基因的表达,其中簇0-3受影响最大。最后,作者在16个细胞簇中获得了4327个特异簇基因(CSG)。每个簇中有91个高度独特的CSGs以点图显示,包括12个拟南芥marker基因的同源基因(图3d)。
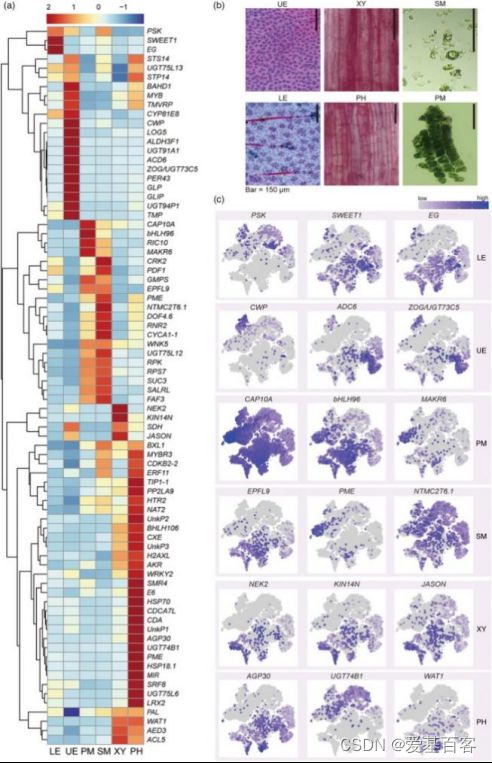
由于没有在单细胞水平上茶树的特定marker基因,作者使用了以下两种策略来注释茶叶细胞图谱中的细胞簇。首先,作者使用特征性的植物单细胞标记来寻找茶树中的同源基因。由于所有聚类的CSGs序列相似性差或没有命中,仅发现少数标记。然后,作者用拟南芥中已发布的scRNA-seq数据和KEGG通络注释分析每个簇的CSGs。这为作者提供了预测的细胞类型识别结果。其次,作者从3 L茶树中分离出6种不同类型的细胞,分别是上表皮(UE)、下表皮(LE)、主脉木质部(XY)、主静脉韧皮部和原形成层(PH)、栅栏叶肉(PM)和海绵叶肉(SM)细胞(图4b)。上述6种细胞类型利用同样的方法进行了消化并进行了RT-qPCR验证。
RT-qPCR鉴定出78个有效基因(图4a)。这6种组织都有自己的特异性标记基因,以及在2种或多种细胞类型中同时表达的基因(图4a)。植物硫氨酸(CSS0039448,PSK)、内切葡聚糖酶(CSS0040022,EG)和双向糖转运SWEET(CSS0018035,SWEET1)仅在LE中高表达,表明它们可能参与保护细胞的渗透压调节。tSNE图显示,PSK在3L中高度表达,另外2个基因在1L中高表达。在UE中,发现了10多个标记,包括3个UDP糖基转移酶和1个预测的细胞分裂素核糖苷50单磷酸磷酸核糖水解酶LOG5。应激反应基因和GDSL酯酶/脂肪酶(CSS0032332,GLIP)在表皮细胞中高度表达。PM和SM中的标记基因相似,但其表达水平远高于其他细胞类型。CAP10A标记基因在PM中的转录丰度高于SM(图4a)。原表皮因子1样基因是拟南芥的表皮细胞标志物。其在茶叶中的同源基因(CSS0030446,PDF1)在SM中的表达水平最高,其次是UE(图4a)。两种细胞周期调节蛋白,丝氨酸/苏氨酸蛋白激酶Nek2(CSS0003940,Nek2)和激肽样蛋白(CSS0030624,KIN14N)在XY中特别表达。一种参与木质素生物合成的氧化还原酶(CSS0041511,SDH)主要在XY和UE中表达。热精氨酸合成酶通过防止细胞过早死亡参与拟南芥木质部规范。其同源基因(CSS0000726,ACL5)在XY和PH中高度积累。在本研究中,PH可能包括韧皮部、原形成层和维管束鞘的一部分。PHLOEM蛋白2样(CSS0016108,PP2LA9)在PH中高度表达,PH是筛子元件和伴侣细胞中最丰富的神秘蛋白之一。此外,还特别在PH中检测到几种细胞周期相关蛋白,如CSS0012344、CSS0021504和CSS0047835。此外,热休克蛋白、组蛋白和转录因子也被证明是PH的合适标记基因。拟南芥的同源基因WALLS(CSS0029088,WAT1),与木质部导管和纤维的发育有关,优先存在于XY和PH中。这与在3L的维管束组织中观察到的木质部和维管束鞘纤维一致(图1h)。选择每个组织的三个标记基因用于tSNE图,以显示细胞表达分布(图4c)。表皮标记基因的表达模式显示与tSNE结果一致(图4c)。
图3.茶叶细胞图谱绘制
基于上述结果,作者首先将16个簇分为3种初级细胞类型:表皮细胞(EC:簇3、5、8和11)、叶肉细胞(MC:簇1、6和7)、维管束细胞(VB:簇2、9、10、12、14和15)(图3c)。然后,通过对每个簇的CSG分析,将簇0定义为增殖细胞(PR),因为该簇的CSGs主要是组蛋白超家族的成员,参与细胞分裂,包括HISTONE4(CSS0031807,HIS4)。4中的CSG显示出与簇2相似的模式,因此作者将簇4置于VB组中(图3d)。根据6个组织中的基因表达,作者将簇13分类为未知叶肉种群(图3d、图4a)。作者应用两个拟南芥标记基因系统和KEGG&GO注释来注释每个簇的所有CSG。最后,作者结合细胞特征将簇9定义为韧皮部细胞(PH),簇12定义为原木质部(PX),簇14定义为原生韧皮部细胞(PP),簇15定义为原形成层细胞(PR)(图1)。此外,根据6种组织的qRT-PCR结果,作者分别将簇6和簇7定义为海绵叶肉(SM)和栅栏叶肉(PM)(图4a)。结果表明,单细胞转录组图谱可以识别茶叶的大多数主要细胞类型(图3a)。
图4.通过qRT-PCR鉴定3L中6个分离组织的标记基因
4、茶树嫩叶的分化轨迹
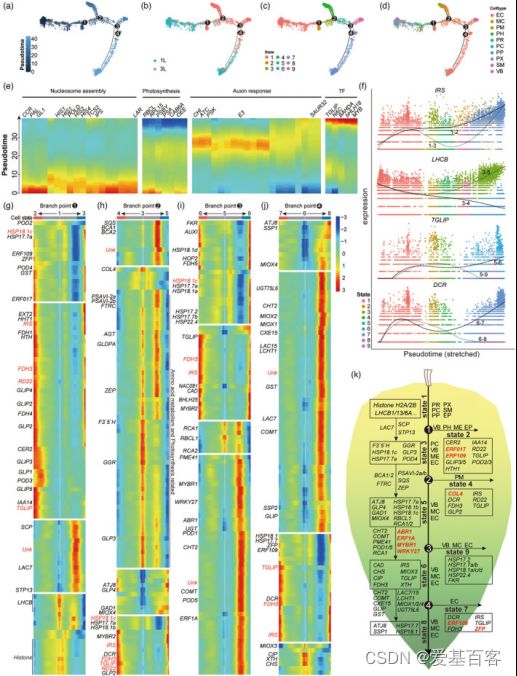
作者进行拟时序分析来验证细胞类型并探索茶叶的连续分化轨迹(图5)。研究将早期分化细胞(如增殖细胞和1 L原形成层细胞)作为起始点(图5a、b、d)。拟时序分析表明,拟时序轨迹有4个分支点,将所有细胞分为9种状态(图5c)。能够分裂1L的细胞在起始点较多(图5b)。表皮细胞分布在所有9种状态(图5d)。PM细胞主要占据分支4(图5c,d)。1 L的PH、PR、PP、PC和SM表现出相似的分布模式,主要在state 1(图5b–d);表皮细胞,未知MS和未知的VB细胞显示出类似的模式,并特异性分布在分支9(图5c,d)。进一步分析以找出参与茶叶生长发育的关键基因。在前50个基因中(图5e),是与苯丙类化合物和类黄酮生物合成相关的基因(图5e,图6a)。BEAM结果提供了一个列表可能决定或反映四个分支点前后细胞命运的基因发生了显著变化(图5f–j)。在四个分支点期间出现了8个基因,包括角质生物合成、植物表皮形态发生、蜡和木栓生物合成以及一种非特异性蛋白质的基因(图5f–j)。每个分支点都有一个代表性基因显示其在不同细胞状态下的表达(图5f)。基于Monocle2的BEAM功能,在4个分支点检测到的显著改变的基因的热图(P<0.01)显示了细胞命运决定时的基因表达模式。基于上述结果,作者绘制了嫩茶叶的细胞分化和发育轨迹,并注释了每个state和分支点的高表达基因(图5j)。
具体而言,state 1的高表达基因主要是组蛋白家族和光合作用天线蛋白(图5g)。分化前,在分支点1和2观察到光合作用相关基因表达的高低波动(图5g)。这解释了1L的薄壁细胞分化为栅栏叶肉细胞和3L的海绵叶肉细胞。从分支点2到分支点4,鉴定了几个基因,包括倍半萜合成酶和玉米黄素环氧化酶(图5h,k)。PM细胞在第4阶段特异性分化。在该阶段高度表达的基因包括参与植物昼夜节律途径的锌指蛋白、FDH3、TGLIP、IRS、RD22和DCR(图5c、d、h、k)。在表皮细胞特异性state 7中,除了PM中的基因外,乙烯响应转录因子ERF109样和锌指CCCH结构域蛋白也高度表达(图5c,d,j,k)。相应的分支点4表明,三种肌醇加氧酶(MIOX1/2/4)和两种漆酶(LAC7/15)可能决定细胞向表皮细胞分化的命运(图5j,k)。在分支点3和4,有许多高表达基因,包括参与二级细胞壁形成的基因,如几丁质酶(CHT)、漆酶(LAC)、XTH、过氧化物酶(POD)、果胶酯酶(PME41)(图5i–k)。作者还观察到,一组LMW HSP基因在茶叶发育过程中表现出不同的表达模式(图5g–k)。
图5.利用拟时序分析方法分析细胞分化轨迹和细胞命运
5、茶叶次生代谢产物生物合成的细胞特异性及其相关基因
已知茶叶的次级代谢产物在叶片发育过程中有规律地变化(图1g)。为了进一步了解黄酮类化合物、咖啡因和茶氨酸的生物合成在叶片发育过程中是否具有细胞特异性,作者分析了与它们生物合成相关的基因在不同细胞类型中的表达。结果表明,参与类黄酮、咖啡因和茶氨酸形成的基因在1L和3L中均表现出细胞特异性(图6)。特别是,在类黄酮生物合成途径中,大多数候选基因在1L中的表达高于在3L中的(图6a,b)。6个PALs(苯丙氨酸解氨酶)中的5个、3个C4Hs(肉桂酸4-羟化酶)中的2个、3个CHSs(查尔酮合酶)中的3个、F3H(黄烷酮3-羟化酶)、2个F3'Hs(类黄酮3’-羟化酶)中的1个,2个LARs(白花青素还原酶)中的1个和5个ANRs(花青素还原酶)中的1个在1L的叶肉细胞中高度表达(图6b)。3个CHIs中的2个(查尔酮异构酶)、2个F3'Hs中的1个、FNS(黄酮合酶)和2个FLS(黄酮醇合酶)主要在1L和3L的表皮细胞中表达(图6b)。3种丝氨酸羧肽酶样酰基转移酶(SCPLs)的转录在1L组织中表达,表皮细胞除外。此外,还有其他基因在3L中细胞特异性表达,如C4H(CSS0005999)和ANR(CSS0024761)(图6b)。茶氨酸和咖啡因生物合成途径的基因也以细胞特异性方式表达。酶的不同同源基因在不同细胞类型和叶片发育的不同阶段被转录。谷氨酸/茶氨酸合成酶(GS/TS)和CSS0022197在1L的PC中表达最高,而CSS0013560在VB中表达最高;而CSS0007758和CSS0050330在3L的PC表达最高。这些结果首次证明了茶树发育过程中细胞类型的异质性和参与次生代谢的基因的时空表达。
作为木本植物,茶树的叶子富含木质素,木质素是次生细胞壁的主要成分之一(图1h)。为了探索木质素代谢,还分析了与类黄酮生物合成共享上游底物的木质素生物合成相关基因(图6a,b)。结果表明,肉桂酰辅酶A还原酶的同源基因在1L的MC中高度表达,在3L中几乎没有转录(图6a,b)。COMT(咖啡酸O甲基转移酶)和CCoAOMT(咖啡酰-CoA-O甲基转移)在3L的VB中高度表达(图6a,b)。4个CAD(肉桂醇脱氢酶)在1L中几乎不表达,但在3L的EP、VB和PC中高度转录。PER(过氧化物酶)在3L导管和表皮中高度表达,但仅在相应的1L细胞类型中轻微表达(图6a,b)。这些基因的高表达提高了特定细胞类型的机械强度,这与叶片的物理支持(VB)和防御(EC)的特性一致。这些结果表明,在发育过程中参与木质素生物合成的基因在不同细胞类型中的表达具有时空特异性。
图6.与木质素和儿茶素的生物合成相关的基因的细胞特异性分布,以及新型糖基化儿茶素的发现
6、在植物中意外发现一种的儿茶素酯葡萄糖基转移酶
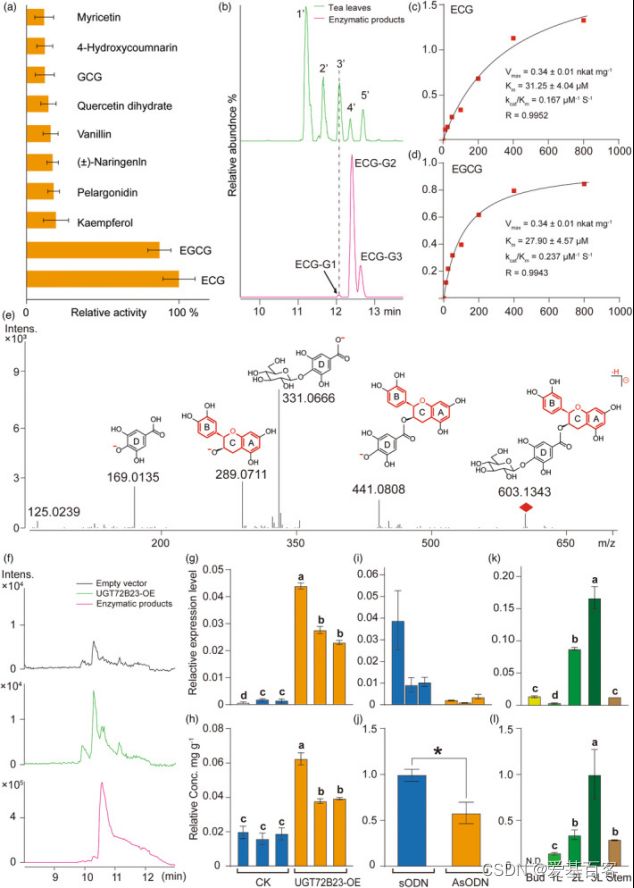
葡萄糖基化是生物活性物质的重要修饰,影响化合物的储存、分布、运输和活性。作者构建了儿茶素基因共表达网络来探讨参与糖基化的UGTs。8个UGT的表达与儿茶素生物合成相关基因的转录相关(绝对spearman相关系数>0.4,P值<0.05)(图6c)。其中一个基因CSS0024764在3L的叶肉细胞中表现出最高的转录水平(图6c),并且在叶肉细胞特别是SM中高度表达(图6d),这表明CSS002464可能是SM的标记基因。
图7. UGT72B23在体内和体外的特征
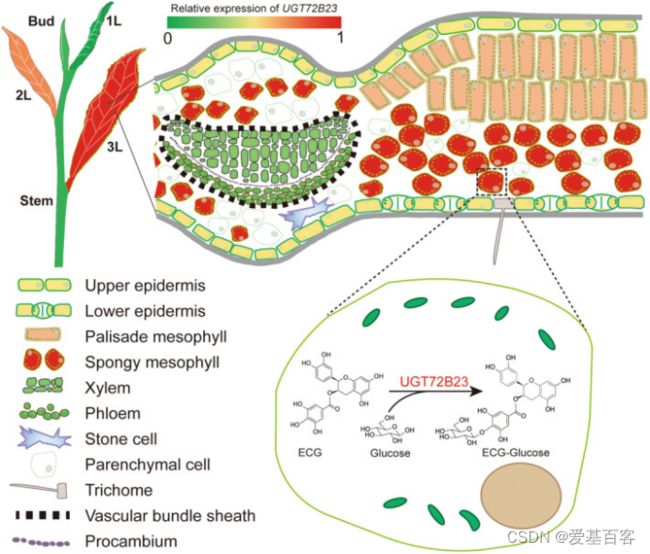
作者对UGT72B23进行了体外和体内克隆和鉴定。出乎意料的是,重组UGT72B23可以特异性地催化儿茶素酯葡萄糖苷的形成,以ECG和EGCG为底物,这两种最重要的儿茶素导致了茶产品的苦味和涩味(图7a)。作者还在茶叶中搜索了ECG/EGCG葡萄糖苷,但只发现了ECG葡萄糖苷(图7b)。通过LC-MS鉴定UGT72B23形成的ECG糖苷(图7e)。通过高分辨率Q-TOF质谱法分析表明葡萄糖与D环结合(图7e)。为了进一步研究UGT72B23功能,作者构建该基因载体在烟草叶中瞬时表达,并在茶叶中下调。当UGT72B23在烟草中过表达时,ECG葡萄糖苷的含量显著增加,而在烟草中未检测到EGCG葡萄糖苷(图7f–h)。单个烟叶中UGT72B23的表达水平与ECG葡萄糖苷的含量密切相关(图7g,h)。与对照叶相比,茶叶中UGT72B23的沉默导致LC-MS测定的ECG糖苷显著降低(图7i–j)。对茶树五种不同组织的分析表明,UGT72B23的表达与ECG葡萄糖苷含量相关(图7k–l)。因此,得出儿茶素酯葡萄糖基转移酶参与了植物中ECG糖苷的形成,反映了植物中儿茶素酯类代谢的复杂性(图8)。
图8.单细胞分辨率下UGT72B23介导的时空特异性ECG葡萄糖苷的形成模型
总结:
茶树是一种经济上重要的木本饮料作物。茶的独特味道是由某些代谢物引起的,尤其是儿茶素酯,但它们在不同细胞类型中的确切形成机制尚不清楚。作者通过建立一种快速原生质体分离方法,并研究了来自第1和第3叶的16977个单细胞的转录谱。首先基于六个分离的组织鉴定了79个标记基因,构建了转录组图谱,绘制了发育轨迹,并进一步描绘了叶片分化过程中不同细胞类型的分布以及与细胞命运转化相关的基因,发现8个不同表达的基因在4个分支点共存。参与某些代谢物生物合成的基因表现出细胞和发育特异性特征。通过叶肉细胞中的基因共表达网络,首次在植物中鉴定到儿茶素酯糖基转移酶。作者首回报道了木本作物叶片中的单细胞转录景观,并发现了植物中儿茶素酯的新代谢途径。
文献链接:https://doi.org/10.1111/pbi.13891
◆ 关于单细胞产品 ◆
爱基百客先后引进10x Genomics 单细胞平台、SeekOne® DD单细胞平台,为客户提供单细胞转录组、单细胞ATAC、空间转录组等科研服务,可以提供从前期样本制备到后期数据分析的完整服务,已协助客户在Protein & Cell、 Journal of Hematology & Oncology等杂志发表诸多高水平文章。
爱基百客在植物单细胞科研服务方面持续进行研发创新与优化,已测试近40余种不同植物材料的单细胞核提取以及原生质体制备,已完成水稻、拟南芥、小麦、烟草等模式以及非模式植物某树的单细胞科研服务。有需求的老师欢迎前来咨询哦~