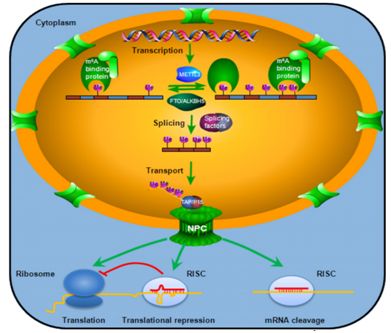
m6A修饰几乎涉及RNA代谢的所有方面,含m6A基因的转录组分析也揭示了最相关的功能途径与RNA代谢有关。基于甲基转移酶和去甲基酶的定位,m6A可以在核或细胞质中被引入或去除。m6A可能对RNA具有不同的作用,这取决于它在细胞核还是细胞质中被检测到。 目前,已确认m6A具有的几个功能。就本专题我们来总结和讨论m6A在RNA代谢中的作用。
m6A作为mRNA的普遍的修饰,在含有METTL3的甲基转移酶时mRNA前体转录后立即发生m6A甲基化;而FTO和ALKBH5负责m6A去甲基化。 通过甲基转移酶和去甲基化酶之间的相互作用,m6A水平保持平衡,形成m6A结合蛋白的对接位点和RNA二级结构的适当组装。具有足够的m6A水平的mRNA转录物可被适当剪接,转运,翻译或降解。而不平衡的m6A调节将在上述每一步引起RNA代谢的缺陷。
1、影响mRNA前体的剪接
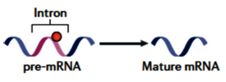
mRNA前体的剪接是基因表达中的重要步骤,它涉及内含子的精确切除和核中初级转录本外显子的连接以产生成熟的mRNA。最早提出的m6A的作用之一是作为RNA剪接的调节剂,目前已有许多证据支持m6A与RNA剪接的相关性,尽管确切的机制尚不清楚。
例如,在经环亮氨酸处理的禽肉瘤病毒感染的细胞中,存在mRNA前体的显著累积,而成熟mRNA的减少;从METTL3敲低的HepG2细胞的m6A-IP/RNA-seq数据分析显示,许多基因特别是甲基化基因显示异构体水平的差异表达,但是基因水平并无差异。同时,剪接的外显子和内含子显着富集了m6A峰,表明m6A与mRNA的选择性剪接之间的内在联系。
M6A对RNA剪接的作用可能是由于甲基化的发生会干扰剪接因子和mRNA之间的相互作用,m6A簇可能作为某些RNA结合蛋白的对接位点;或者,由于m6A使A-U碱基配的稳定性降低,RNA二级结构可能受到影响。另一个可能的机制是通过甲基转移酶或脱甲基酶的相互作用,最近对ALKBH5的研究提出了m6A水平可能影响剪接因子的基因表达的另一种可能性。
2、调控RNA的核输出
RNA剪接后,成熟的mRNA必须从细胞核中输出以在细胞质中翻译或降解。研究者检测到STH处理的HeLa细胞中细胞核mRNA的保留时间增加了40%,但是多聚腺苷酸化的RNA没有变化。在具有增强的m6A水平的ALKBH5缺陷型细胞中,通过5-溴尿苷(BrU)掺入分析观察到新生合成的RNA主要分布在细胞质中。
据报道,不同的RNA种类通过核孔复合物利用不同的途径进行核输出。TAP-P15复合体是在衔接蛋白如ALY/REF衔接子、SR蛋白和TREX复合物的协助下用于mRNA输出。由于ASF/SF2的磷酸化水平决定其在剪接或核输出中的功能,因此推测由ALKBH5缺陷引起的ASF/SF2磷酸化减少将加强其与TAP/P15复合物的相互作用从而导致核mRNA输出加速。与mRNA不同,rRNA可以招募几种不同的途径使其出口更有效率。rRNA核出口可能不会受到ALKBH5缺陷的显着影响。有趣的是,ALKBH5缺陷也导致细胞质中SRPK1蛋白异常聚集。 SRPK1负责剪接因子的磷酸化,以促进其参与前mRNA的剪接。
3、调控mRNA翻译
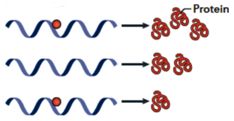
大多数m6A修饰发生在外显子,m6A在剪接后仍保留在成熟的mRNA中,因此,m6A也可以影响含m6A的mRNA的翻译。小鼠DHFR mRNA体外甲基化后用兔网织红细胞系进行体外翻译,当比较甲基化转录物的翻译水平和非甲基化转录物的翻译水平时,检测到甲基化的Mrna的翻译1.5倍增加。当从环亮氨酸处理的细胞中纯化的细胞质转录物在体外翻译时,由甲基化mRNA产生的DHFR蛋白的量比未处理的mRNA低20%。
近期的使用体外翻译以及将报告基因mRNA转染入细胞的研究显示,与未甲基化的转录物相比,腺苷甲基化导致翻译减少。因此,m6A对蛋白质生产的影响似乎在不同的mRNA中是不一致的。一种可能性是这种效应部分由转录本内的其它顺式作用因子决定,或者mRNA中m6A的位置可能影响其与特定的介导其对翻译的作用的反式作用因子相互作用的能力。
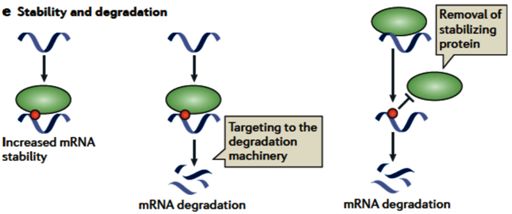
4、影响mRNA的稳定性
mRNA降解的调节是影响总体细胞mRNA丰度的主要因素。由于在poly(A)尾部中未检测到m6A,因此它可能不涉及聚腺苷酸化依赖性的mRNA降解。 Camper SA等人已经通过用STH处理HeLa细胞来检查对mRNA稳定性的影响发现,尽管在高达500μMSTH的存在下m6A抑制几乎完全,但mRNA稳定性没有受到很大的影响。然而,如通过高通量测序分析所鉴定的,m6A富集在3’UTR区域中,3’UTR包含mRNA降解所需的几个重要功能域,如富含AU的元件(ARE),铁反应元件(IRE)和细胞质聚腺苷酸化元件(CPE)。同时,3’UTR是microRNA(miRNA)靶向的区域,因此不能排除m6A参与调控mRNA稳定性的可能性。
举例来说,潜在的m6A结合蛋白ELAV1 / HuR能够结合ARE区并稳定相应的转录物。对照和METTL3敲低细胞中差异mRNA表达水平的分析表明m6A稳定mRNA。甲基化的失去降低含有m6A4的转录本的表达水平。这种效应对于在内含子中含有m6A的mRNA是最突出的。这些数据的一个可能的解释是m6A是正确剪接mRNA所需要的,当被破坏时导致剪接受损和随后的mRNA降解。m6A对mRNA稳定性的影响可能是基因特异性的,因此全局RNA稳定性的显着变化不太可能发生。
5、与microRNA的关联性
MeRIP-Seq数据集的分析揭示了m6A与miRNA结合位点之间的存在着很强的相关性。含有m6A峰的67%的3'UTR也含有至少一个TargetScan预测的miRNA结合位点。因为大约30%的基因在其3'UTR中具有miRNA结合位点,所以这是显着增强的关联。重要的是,m6A峰和microRNA位点不重叠。通常,m6A峰在终止密码子附近是最丰富的,并且通常沿3'UTR长度频率降低,而microRNA靶位点在3'UTR的5'和3'末端富集.m6A在3'UTR和miRNA结合位点的存在提示了mRNA甲基化和microRNA之间的相互作用。确定腺苷甲基化是否有助于microRNA诱导的mRNA沉默的作用将是重要的。
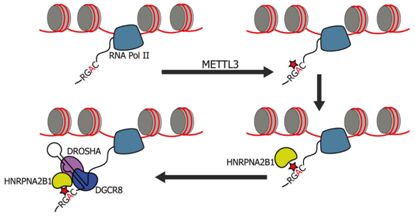
另外,目前已有相关证据证明了m6A影响microRNA前体的剪接加工:m6A在转录本上的存在会影响选择性剪接,但是这种标记的核阅读器能够介导核转录本的处理,但还没有被确定。研究人员发现RNA结合蛋白HNRNPA2B1在体内和体外结合带有m6A的RNA, HNRNPA2B1直接结合一组核转录物并以与m6A“作者”METTL3类似的方式调节其选择性剪接。此外,HNRNPA2B1与初级miRNA转录本子集中的m6A标记结合,与microRNA微处理器复合蛋白DGCR8相互作用,并促进pri-miRNA加工。
--------------------------------------------
参考文献:1、Xu Zhao,Ying Yang,Bao-FaSun,et al.FTO-dependent demethylation of N6-methyladenosine regulates mRNAsplicing and is required for adipogenesis.Cell Research,2014,24:1403-1419
2、Kate D. Meyer,Samie R.Jaffrey. The dynamic epitranscriptome: N6-methyladenosine and gene expressioncontrol.Nat Rev Mol Cell Biol,2014,15(5):313–326
3、Hao Du,Ya Zhao,Jinqiu He,etal. YTHDF2 destabilizes m6A-containing RNA through
directrecruitment of the CCR4–NOT deadenylase complex.NAT COM,2016,7:12626
4、Yamei Niu,Xu Zhao,Yong-ShengWu,et al.N6-methyl-adenosine (m6A) in RNA: An Old Modification with A NovelEpigenetic Function.Genomics Proteomics Bioinformatics, 2013,8–17
5、Xiao Wang,Zhike Lu,AdrianGomez,et al. N6-methyladenosine-dependent regulation of messenger RNAstability.LETTER,2014,10.1038/nature12730
6、Claudio R. Alarcón,HyeseungLee,Hani Goodarzi,et al. N6-methyl-adenosine (m6A) marks primary microRNAs for processing.Nature,2015,519(7544):482–485
7、Claudio R. Alarcón,Hani Goodarzi,HyeseungLee,et al. HNRNPA2B1 is a mediator of m6A-dependent nuclear RNA processingevents. Cell,2015,162(6):1299–1