Nature Neuroscience:利用MRI研究神经解剖学
通过影像学方法研究神经解剖学,有助于深入了解我们的大脑是如何运作的,是如何被基因和环境塑造的,以及是如何随着发育、衰老和疾病而变化的。核磁共振成像(MRI)的图像采集、图像处理和数据建模的发展是关键。MRI成像提供了一个间接测量生物信号的方法。因此,正确识别和解读伪影对结构MRI非常重要。在本文中,我们概述了测量宏观和介观结构以及推断微观结构特性的方法;还描述了可能导致错误结论的关键伪影和混淆因素。最终,我们相信,尽管方法需要改进,解释也需要谨慎,但结构MRI在进一步了解大脑如何工作方面仍有很大的潜力。
神经解剖学的研究可以追溯到古埃及,并由托马斯·威利斯(Thomas Willis )对大脑和神经的开创性追踪而进入现代。长期以来,大脑被视为意识和思想的所在地。19世纪,Broca, Wernicke 和 Lichtheim 的研究证实了认知和单个大脑区域之间的直接联系。Ramon y Cajal、Von Encopo、Brdman等人对脑区细胞组成类型的详细研究,奠定了我们目前对中枢神经系统解剖的理解基础。随着我们越来越确定功能定位于特定的大脑区域,以及这些大脑区域进化的相关问题。这反过来引发人们思考,这些脑区的大小或形状与认知能力的个体差异,或疾病进展之间可能存在的关系。
20世纪70年代末和80年代初,MRI成像的出现彻底改变了神经解剖学的研究,因为它首次实现了在体研究,并具有足够的对比度以区分脑区。90年代,为基于MRI的神经解剖学研究引入了计算方法。与此同时,出现了新的定量或半定量MRI技术,使研究人员能够估计体素内的微观结构。自动化处理管道的出现,进一步推动了对成像数据的大规模分析。
从活体成像中获得高质量的详细信息,已经彻底改变了我们对神经解剖学和结构-功能关系的理解,并对多种疾病过程有了深入的了解。然而,围绕着图像获取、分析、研究设计和解释,还有很多问题需要考虑。本文为读者提供了这些问题的概述,使读者能够根据自己的需求选择最合适的工具包。本文发表在Nature Neuroscience杂志。
方法概述
理解基于MRI的神经解剖学测量方法的关键在于,MRI并不是直接测量我们想要推断的亚细胞结构。分辨率有限以及间接测量原理,提醒人们不要将MRI结果简单地外推到神经生物学结论。与“给大脑拍照”这一常见比喻相反,MRI测量的是应用电磁波(射频),由氢原子发出射频信号,使用空间变化的磁梯度对信号进行定位。每个体素(一个三维像素)的对比度取决于体素内质子的密度和局部组织微环境的特性,这些特性要么与氢的磁性直接相关,要么可以通过操纵磁场来检测。产生的对比度取决于磁场操作(脉冲序列)的精确时间,如图1所示。
图1:出生队列(a birth cohort )的成员20岁时的多模态脑结构图像的冠状切片
最左边:T1加权(T1w)图像最常用于分析大脑体积、基于体素的形态学测量、皮质厚度等。
接下来,从左到右是定量T1和T2(分别为qT1和qT2)以及髓鞘水分数(MWF)图,使用T1和T2(mcDESPOT)序列的均衡单脉冲进行估计。
右边三幅图像:FA和平均扩散率(MD),均来自扩散成像以及(最右边)磁化传递率(MTR)图。
这些数据表明,一次扫描,即可从扫描的MRI成像中获得关于大脑结构的丰富信息。
为了提供更多细节信息,组织对比度取决于T1和T2弛豫,这两个独立的过程描述了应用射频脉冲后的自旋(即磁性)行为。T1也叫纵向弛豫,指横向磁化矢量在停止激发后恢复到纵向磁化矢量的过程。T1值由大分子浓度、水结合和水含量决定,髓鞘缩短T1,水肿延长T1。T2或横向弛豫描述了由于微尺度或纳米尺度的局部组织环境变化,而使自旋彼此不对齐的过程。T2效应被观察为信号衰减,灰质的T2弛豫时间比白质长。结构MRI研究几乎均使用“加权”成像,其中信号强度与T1和T2有关,而不是量化某些特性(这些特性通常更有效,在给定的采集持续时间内提供更大的信噪比)。
一旦获得了图像,测量大脑结构涉及两种互补的方法:
(i)宏观或介观,考虑多个体素的大小和形状;
(ii)微观,从体素内部获取信息。宏观和介观神经解剖学。
在宏观或介观尺度上研究大小和形状的五个领域:
(1)手动体积测量法,由解剖学家从脑部图像中手动分割感兴趣的区域。虽然在许多方面,手动体积测定仍然是金标准,但很难扩展到多扫描(尤其是针对数千名参与者的现代研究)和多脑区研究。因此,手动体积测定法的主要用途是在一个单一的、有重点的假设下进行较小的研究,以及创建数据集,将其纳入自动分割算法。
(2)自动分割算法,旨在取代大多数情况下的手动体积测量法。在某些情况下,手动分割的数据集用于线性和非线性图像配准、组织分类和相关图像特征的某些组合上划分新数据库,而对于其他算法,则不需要手动训练。解剖学家的时间被用来换取计算机时间,计算密集的多图谱方法和/或额外的基于表面的约束增加了精确度。手动体积测定法和自动分割法之间的一致性表明,两者之间的对应关系将不断改善。
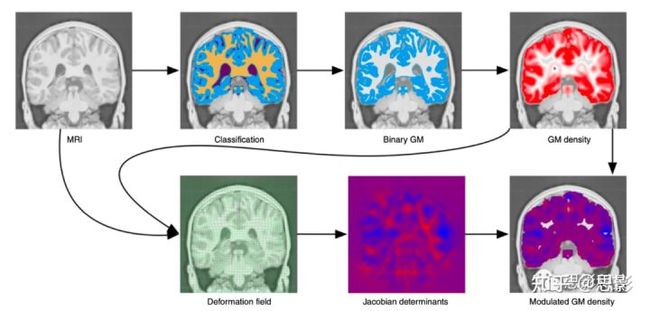
(3)两类形态测定法通常用于分析神经解剖学,而无需预先限制定义的感兴趣区域:即基于体素的形态测量(VBM)和基于形变的形态测量(DBM)。如图2所示,在VBM中,大脑分为白质、灰质和脑脊液;选择单个组织类别,然后用高斯核模糊,以估计每个体素处该组织类型的局部数量,然后在线性或粗略非线性对齐后,在受试者之间进行比较。在DBM中,利用非线性方法将大脑转化为标准空间或进行彼此转化,变形场要么直接分析,要么简化为体积变化的标准量度,即雅可比行列式,然后在受试者之间进行比较。将这两种方法结合以优化VBM,其中组织密度测量由雅可比行列式调制。
图2:基于体素的形态学测量(VBM)
VBM被广泛用于确定多组受试者的神经解剖学改变。VBM需要将大脑(MRI)分类为白质、灰质(GM)、脑脊液和非脑组织(分类),提取其中一种组织类型(二值化GM),然后用高斯核平滑提取的组织类型。最终的结果是一个图像(GM密度),在线性配准的立体定向空间中,其值范围为0到1,表示由模糊核确定的局部邻域内的灰质量。2001年提出了对基本VBM协议的修改(参考文献11),纳入了基于T1WI成像或GM密度图对齐的非线性配准,以实现更好的空间对齐。这种优化的VBM程序还通过将组织密度图乘以(或调制)非线性变形场的雅可比行列式,将非线性配准(变形场)与从经典VBM获得的组织密度图相结合,以生成调制的GM密度图。
(4)大脑皮层的复杂折叠模式,对计算神经解剖学提出了挑战,但是随着基于表面的算法的发展,这一点已显著改善,如图3所示。在这里,使用可变形模型对皮质的内外表面进行分割,并提取皮质厚度和表面积等测量值。可以从皮质表面的三维模型中提取的各种解剖学指标,捕捉到不同的发育过程,并显示出与人口统计学、遗传学、环境和临床变量之间的不相关关系,强调将经典体积法应用于解剖分析的价值。基于表面的方法也为大脑皮层提供了一个改进后的坐标系,允许对皮层上的信号进行平滑处理,并基于表面的对齐,以使个体更接近对应关系,以便进行统计比较。
图3:基于表面的分析
通过组织分类和可变形模型的分割技术,提取皮质的内表面和外表面。然后,可以根据内外表面之间的距离计算皮质厚度,以及在任一表面上计算的表面积(未显示)。为了进行受试者间的统计,以及将皮质分割为叶、脑沟和脑回,在表面(受试者的deep potential)和模型(模型的deep potential)上计算曲率(或者脑沟深度或deep potential的某些度量)。然后,基于表面的配准将分割模型用于分割输入表面(分割对象)。
(5)白质束的位置和大小可以通过扩散张量纤维束成像来估计。下面将详细介绍水扩散的测量方法,用于追踪脑白质纤维束路径,然后对每个通路的特性进行推断。在最近的一篇综述中,我们更详细地描述了追踪大脑宏观连接的益处和注意事项。
由于MRI不能直接显示基础解剖结构,其测量结果如皮质厚度或VBM,取决于序列和硬件的选择。例如,7T MRI的皮质厚度测量值低于3T MRI的测量值。在分离灰质和白质方面,大脑皮层不同的组织特性带来了不同程度的挑战;运动皮质的下层有大量髓鞘,因此,与组织学测量相比,基于磁共振(MR)的厚度估计(尤其是在早期研究中)往往低估了其真实厚度。硬件的不断改进和磁共振序列的发展使成像测量结果越来越接近尸检结果,但在解释成像数据时,需要始终牢记磁共振信号的性质;我们所测量的结果并不总完全等同于解剖学家所估计的结果。这将是一个更大的问题,本文稍后将对此进行讨论。
微观结构:微观水平的MRI。
磁共振成像(MRI)中的微观结构,指的是各体素内部的微观结构,其研究主要是扩散磁共振成像(MRI)的领域。在这里,水分子的热驱动随机运动是对局部微环境的探测,这种运动的限制被用来推断成像体素内的组织结构。 最初的研究模拟了椭球形扩散水分子的散射模式,用张量表示。可以从扩散张量导出各种度量,例如分数各向异性(FA,表示形状的拉长程度),以及平均、轴向和径向扩散率(即沿不同轴的椭圆半径)。这些指标的变化反映了水扩散剖面的变化,因此与底层组织微结构边界的改变有关。它们可以在个体之间的体素水平进行比较,或者在基于纤维束造影术的纤维束分割后,在纤维束上进行平均。为了克服配准问题,引入了基于骨架的方法,将值投影到代表主要束中心的平均FA骨架,这也消除了纤维束边缘的部分容积效应。
虽然基于张量的扩散MRI数据建模,对微观结构的改变很敏感,但不是特定组织的特异性变化。此外,在具有复杂纤维模式或显著限制的区域(例如,特定亚细胞结构中的水滞留),张量模型不能捕捉底层结构,仅提供平均单峰近似值。多壳扩散磁共振或对扩散过程具有不同灵敏度的扩散MRI(通常通过实验参数b进行量化),为分析提供了新的可能。
多壳扩散磁共振可以使用高阶近似值(如扩散峰度模型),以偏离张量模型(也偏离复杂的微观结构)。甚至扩散测量估计的峰度也缺乏直接的生物学解释,类似于张量模型中的参数;然而,基于模型的映射提供了解决方法(另请参见Box1)。随着建模和采集方法的发展,可以获得更具特异性的估计值。例如,可能的推断范围从绘制白质中的交叉纤维,到估计灰质中的神经轴突密度。Box1总结了这些方法。
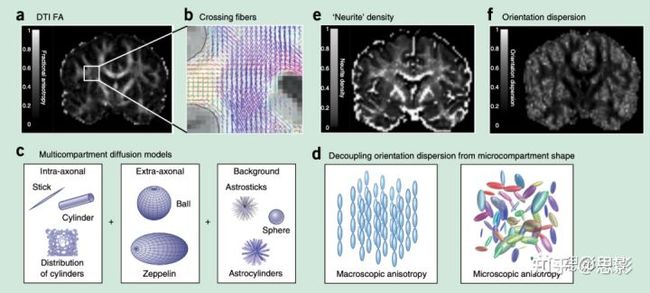
Box1:先进的扩散模型。基于张量的扩散MRI数据建模,假设水分子按照各向异性中的高斯分布随机分散(即,由椭圆描述)。张量模型可以提供对组织微观结构变化敏感的标记,但基于张量的指标并不特定于生物学上的组织特性。由张量产生的测量值如FA(图4a)反映了几何特性(纤维复杂性;图4b)、生物物理特性(纤维大小和/或纤维密度)和测量方面特性(扩散时间和/或b值)。生物物理模型,通过将信号参数化为内在组织特性的函数来帮助解释。早期,观察扩散信号的多指数衰减(尤其是在高b值下),激发了多隔室模型(图4c)。例如,早期模型认为细胞外空间会阻碍扩散(高斯运动,但扩散系数降低),细胞内空间会限制扩散(本质上非高斯)。在这些基础上,扩展了有几种方法(尤其是在白质建模方面)。球棍模型(ball-and-stick model)捕捉到了受限的、完全各向异性的轴内扩散(stick)和各向同性的轴外扩散(ball)。复合阻碍和限制水扩散(CHARMED)模型用固定直径的圆柱形纤维代替,并用张量模拟额外的轴突空间。之前的模型假设纤维取向均匀。有很多方法估计纤维取向密度函数(fODF),它描述了每个成像体素中纤维取向的分布,该方法主要用于纤维束成像,可以提取一些微观结构信息。然而,多隔室白质模型(图4d)中明确表示了纤维弥散,该模型放宽了取向均匀性的假设。弥散模型也越来越多地被用于推测灰质区域。最近,NODDI(神经轴突定向分散和密度成像)模型能够利用在活体成像中可行的扫描时间,从常用临床扫描仪上获取的图像中估计类似的测量值(图4e,f)
图4 弥散模型概述
虽然基于扩散的成像方法是推断微观结构的主要方法,但其他定量成像技术可提供独特的信息。磁化转移(MT)成像,反映了自由水质子和大分子(如蛋白质)束缚的质子之间的相互作用。MT通常用于研究白质的结构特性,其中髓鞘的大分子是信号的主要来源。由于MT对蛋白质含量的敏感性,还可用于探测受损组织和炎症。获取MT数据的最快方法是进行两次采集(有或无MT饱和脉冲),然后将计算两次采集之间的信号变化百分比,作为MT比率。化学交换饱和转移(CEST)成像是MT的一种变体,它可用于检测中风病灶中的pH变化和描绘肿瘤。
除了使用加权图像进行后续图像处理,还可以直接量化T1和T2。其目的是为了更好地推断局部组织的组成。定量T1和T2映射的主要缺点是,等效信噪比(SNR)和分辨率所需的时间要多得多,因为金标准方法需要在多个回波或反转时间获取数据。如果想要绘制髓鞘等特定区域的映射图,通常需要估计每个体素内的多个T2值,这就更加复杂了。存在更快的近似值,但在报告的指标中这些方法存在显著差异,因此仍需要校准金标准。
上述序列都依赖于振幅信息和移除相位信息。然而,相位信息可用于识别组织间的易感性变化。例如,相位图像可用于量化体素中组织的平均磁化率,这可以说是比上述许多基于弛豫时间的方法更直接的组织磁性测量。这种被称为定量敏感性标测的方法已被证明会随着组织铁、髓鞘和钙的变化而改变。
结构磁共振成像的应用大脑的空间组织及其微观结构特征,是编码在基因组、发育史和经历环境中的信息的物理表现,因此几乎涉及神经科学的每个方面。如上所述,MRI能够在短时间(约1小时)和大规模(超过1000名参与者)内以可靠的方式(测试-再测试相关性>0.75)推导出大脑结构的多个(半)定量特征。显然不可能在这篇综述中,概述大脑结构MRI研究所涉及的神经科学的所有方面。我们提供了两个示例:
第一个,将遗传学和流行病学与脑成像相结合来研究人群(Box2)。
第二个,成人认知、行为和精神疾病的个体差异往往与婴儿期、儿童期和青春期出现的早期发育差异有关。结构神经成像在揭示这些发育相关联系中发挥着特殊作用,因为大脑结构的变化在短期和长期都起作用(Box3)。
Box2:群体神经科学(Population neuroscience )整合了流行病学、遗传学和神经科学,以确定从受孕人类大脑发育的变化。面临三个关键挑战:
(i)从内部(基因及其调节)和外部(社会和物理环境)影响大脑的因素的无限组合;
(ii)发育级联的存在,这些级联从一个时间点到下一个时间点(例如,产前到产后),从一个器官到另一个器官(例如,心脏代谢器官到大脑),从一个组织层次到另一个组织层次(例如,行为到基因调控,反之亦然);以及
(iii)人脑的结构和功能复杂性。
这些通过大样本研究(一般人群受试者)来应对这些挑战,使用最先进的工具来评估基因及其调控、外部和内部环境以及大脑特性,所有这些都是以综合方式在整个生命周期内完成的。与临床(病例-对照)研究不同,群体神经科学并不关注患者。理想(即代表性)样本包括健康个体、处于疾病临床前阶段的个体以及疾病患者,其数量对应于特定年龄段不同疾病(及其前因)的人群患病率。环境和基因组的广泛取样对于确定在不同情况下塑造大脑能力(和健康)至关重要。
许多群体研究将MRI成像与各种环境信息相结合,包括内部环境(例如,血浆激素、脂质、微量营养素水平)、物理环境(例如,空气污染)和社会环境(例如,家庭和社区的社会结构),以及受试者的经历(例如,有压力的生活事件)。评估“外部”环境具有挑战性。除了在多个领域(例如认知、心理和心脏代谢健康)进行扫描和评估外,队列参与者还提供了血样,可用于随后的全基因组、转录组和表观基因组分析。多年来,人类大脑的各种结构和功能特征的多模式整合一直是通过使用一个共同的参考系统来实现的。
Box3:结构神经成像观察大脑发育 我们通过一项结构神经成像研究,首次对活体人脑动态发育进行纵向观察,该研究揭示了人类灰质体积的成熟轨迹遵循一条“倒U”曲线,而不是呈线性进展。之后,涌现了大量大规模纵向结构神经成像数据集和相关研究报告,这些研究报告详细描述了大脑内神经解剖学成熟的时空异质性,并绘制了大脑结构发育如何随基因、环境、人口统计学(例如性别)、认知和临床因素等变化的。这里指出结构神经成像的几个特殊的机遇和挑战:
首先,自动化图像分析可以从任何给定的结构神经成像中提取大量形态学评估值。例如,皮质形态测量的方法在一次扫描中测量皮质厚度、表面积、体积、曲率和沟深度。很明显,这些指标遵循不同的轨迹,反映了不同的遗传和环境影响,但可以用时空特定的方式相互关联。这些观察结果有助于优化对结构神经成像分析的设计。
第二,任何定位解剖变化的研究都需要有这样的认识,即大脑大小和形状的区域变化不是相互独立的,也不是独立于全脑大小差异的。从统计学角度来看,有一个问题,即在分析感兴趣区域(ROI)时,如何最好地“解释”全脑大小;传统上,在对ROI解剖结构的变化进行建模时,可以通过按比例调整ROI测量值或将全脑体积作为线性协变量来解决这一问题。然而,最近的一些研究强调了ROI大小和整体大脑大小之间的关系往往是高度非线性的,并表明了传统方法无法控制这些非线性。
第三,除了分析挑战外,神经结构成像了解大脑组织提供了一个新的方法,并为检测发育或疾病相关过程的脑变化提供了方法。至关重要的是,人脑中解剖共变的规范模式似乎限制了疾病效应的空间分布,这提高了我们在临床人群中分析和解释结构神经成像表型的能力。
第四,图像采集和图像处理技术使我们能够探索大脑的早期发育。子宫内3D成像必须处理扫描过程中胎儿的大幅度旋转。此外,在发育中的大脑中,快速的髓鞘形成和类似的变化会导致MR对比度的变化(即T1和T2),贯穿生命的前24个月。因此,图像处理算法必须适应这些变化。最后,早产受试者也为早期大脑发育提供了新的见解,还可以进一步捕捉环境变化对早期大脑发育的影响。
最后,大脑结构不仅仅可以作为一系列独立的分割区域甚至体素来分析。神经解剖也可以用协方差网络来研究。使用脑成像技术研究大脑网络最早来自于激活和静息状态功能MRI或正电子发射断层扫描(PET)研究。在受试者群体中,使用VBM或皮质厚度将种子区域与大脑其他部分关联时,出现了相似的网络。这种结构协方差网络的变化与正常发育、衰老以及多种疾病过程有关。然而,无论是从功能成像还是纤维束追踪方面,网络的测量方法之间的联系都是模棱两可的,显然需要更多的工作来理解结构协方差网络的起源和意义。
正问题,反问题:什么是信号源,我们能做出什么样的推论?
对成像中的感兴趣发现,往往很难确定它们的分子和细胞基础。用MRI研究大脑可塑性是个很好的例子。伦敦出租车司机海马灰质“密度”改变(通过VBM测量)的早期识别表明,或许可通过MRI研究人类的学习和记忆过程。研究显示了成年人如何处理视觉和顶叶皮质中灰质浓度的变化,这种变化最快在7天内发生,同时伴随着白质中水分子扩散的变化。在玩视频游戏的2小时内,甚至可以通过扩散MRI检测到微观结构的变化。多组研究表明,MRI可以检测运动协调任务和音乐训练等方面的大脑可塑性。尽管这些研究很有趣,但也存在一些反驳和争论。例如,据Bengtsson等人研究报道,钢琴练习后的变化区域大多位于白质束的边缘,因此可能代表白质束厚度的变化,而不是白质束的微观结构特性。杂耍是诱导大脑结构可塑性的研究最多的训练任务,经常显示视觉和顶叶皮质的变化,但这些效应的精确定位很难重现。在一项对接受操纵杆任务训练的成年人进行的研究中,发现检测大脑可塑性极为依赖于图像处理过程中所选择的方法,而且似乎是受人为影响的。
然后,进行了动物模型研究,尤其是小鼠和大鼠。当然,啮齿类动物模型的优点是,可以在MRI评估后进行侵入性组织学和免疫组织化学实验。最初,研究证实,学习会引起局部脑体积和扩散特性的变化。这种变化可以在1天内检测到,但似乎会持续数周或数月。在相关性水平上,白质的扩散特性变化与髓鞘标记物相关;灰质的扩散特性变化与星形胶质细胞和突触标记相关。体积变化与突触标记物相似,尤其是GAP43(轴突生长锥指标)、树突棘计数和戊二酰氨基浓度。在微观和介观变化之间建立更多的因果关系,这才刚刚开始;例如,辐射已经被证明可以阻止神经发生和运动相关海马体积的增加。在将分子机制与MRI成像相结合方面,基因小鼠模型有望发挥重要作用。
即使使用动物模型直接解释MRI信号,因果关系仍然是存在的。健康个体参与学习任务的情况下,海马体灰质的增加可能与未来的突触变化有关。在病理状态下,相同的海马体积变化可能是由完全不同的细胞机制引起的。先进的MR序列,尤其是微观结构建模方法,特异性高于体积测量方法。Jespersen等人利用啮齿类动物模型,比较了体外多壳扩散数据与髓鞘和细胞体染色组合。他们确定了神经轴突密度(根据高级扩散MRI模型估计)和髓鞘映射图之间的高度相关性;此外,基于细胞结构的生物物理模型明显优于简单的张量模型。类似地,相关研究发现,由改良的NODDI模型和电子显微镜测量的胼胝体髓鞘密度之间存在密切关系(Box1和图4)。Stikov及其同事发现,将定量磁化转移与多壳层扩散成像相结合,可以准确估计g比值(髓鞘内外径之比)。这些例子说明,该领域正越来越接近准确评估直接测量的神经形态,但显然,要建立现有测量的准确度和稳健性水平,并扩展到新的基于生物学的指数,还需要做更多的工作。我们需要记住,从我们的测量值到组织生物物理性质,需要间接映射或推断,以避免对结果的过度解释。
昂贵的运动检测器?MRI伪影和注意事项
核磁共振成像并不是一幅简单的大脑图像,它有很多优点,即不同的脉冲序列可以获得多个对比度,但也可能会导致一系列伪影,这些伪影会混淆对结果的解释,甚至可能导致完全错误的结论。在MRI中,伪影的普遍性和多样性源于基本的物理学难题,即使空间中主磁场(B0)均匀或形成线性强度斜坡,以及使空间中的射频(RF)B1场均匀。此外,需要对这些场进行快速、准确、可再现的时间调制,并对图像进行编码。数据编码发生在空间频率域,导致MR伪影具有与其他成像系统伪影完全不同的特征。此外,即使是细微的个体间差异,也会影响结果。最后,通过图像处理,尤其是空间标准化,导出用于统计分析的指标。因此,形态学研究的关键是要确定伪影的可能来源,并明确当混杂因素与预测因素(即患者比对照组移动更多)分离时,伪影是否可感知生物效应,以免使核磁共振成像成为昂贵的运动检测器。
受试者运动形态学
研究中最常见的混淆因素是受试者的运动伪影。虽然几十年来人们已经知道受试者运动会影响MRI成像结果,但直到最近才开始量化运动伪影的影响。对运动相关偏差的重点关注,首先是在功能性神经成像数据中进行,然后扩展到结构性神经成像中。由于(i)采集是在空间频域中进行的,因此运动对重建图像的影响将因时间、方向和运动量的不同而有所不同,因此很难解释受试者运动的影响,(ii)在绝大多数研究中,运动量与我们所研究的效应相关(例如,老年人比中年人运动伪影多;疾病程度较重者比疾病早期者运动伪影多;受试者运动量可能会受药物影响)。此外,在萎缩相关的研究中,运动伪影对图像信息的影响,与我们的预期一致:运动伪影会导致灰质明显减少,使其很难与真正的萎缩区分开来。对于扩散MRI估计的微观结构,即使在仅比较预期无差异的对照组与受试组时,运动伪影也会导致组间伪差异。这些现象给神经影像数据的收集、分析和解释带来了特殊的挑战,因为(i)运动是非随机分布的,与年龄(儿童比成人运动多)、性别(男性比女性运动多)和临床状态有关,(ii)运动诱发的偏倚在大脑区域(例如前额叶皮层)中很明显,这些区域因年龄、性别和疾病状态的不同而表现出明显的解剖差异。事实上,排除基于运动伪影的扫描,会影响关于大脑发育中神经解剖学变化轨迹的结论。
解决神经成像中运动伪影的方法,可分为试图最小化运动影响的事后策略(post hocstrategies)和试图降低运动伪影产生的前瞻性策略(prospective strategies)。最基本的事后策略是估计每次扫描中的运动量,然后排除任何超过设定值和/或对照组个体运动幅度的扫描。这当然是低效的,因为它有时需要丢弃最好的数据,并可能排除某些设计。运动估计值也可能被用作统计分析中的回归器,以“控制”运动效果。
对于扩散磁共振成像(diffusion MRI),每个体素都有多个测量值,运动会使评估的映射图模糊。此外,难以估计受试者的运动,因为它与硬件相关的伪影(涡流)和场不均匀性失真相互作用(见下一节)。检测和纠正这些问题的性能已经得到了改进。评估了运动和伪影后,可以检测到异常数据,并将其轻量化或用非异常值的平均预测值替换,以使偏差和对后续分析的影响最小化。
与事后策略相比,前瞻性策略寻求在扫描过程中检测并解释受试者的运动。运动的检测和校正方法有两种基本形式:(i)由外部跟踪设备提供,或(ii)由MRI信号本身跟踪运动。后者可以直接实现,或者通过嵌入结构或扩散扫描中的短时间“导航器”序列来检测和解释运动。前者的例子包括带有反射标记、射频标记、磁性标记和惯性导航系统的摄像头。基于标记和传感器的系统的缺点是,标记或传感器通常附着在皮肤上,而皮肤可能不会随大脑移动。附着在上牙上更可靠,但需要专业知识来设置,并需要患者有牙齿。另一种系统使用面部几何体作为跟踪模式。基于摄像头的系统要求能清晰捕捉到拍摄对象的头部。
与外部跟踪系统相比,另一个选择是使用MR机器本身来跟踪和消除运动效应。如果在序列中使用额外的导航器,它们可能会增加扫描时间,但有时会插入许多MR序列中存在的“死区时间”,在此期间,当磁化发生变化(衰减或恢复)时,仪器处于空闲状态。这些方法通常比外部跟踪系统更慢,但不需要特殊设置。
磁场不均匀性
B0(主磁场)不均匀性和敏感区域。理想情况下,主磁场(B0场)应在空间上均匀。在随位置变化的磁场中,应用线性斜坡来编码空间信息。在实践中,初始均匀场也会因受试者的存在而改变。磁化率(magnetic susceptibility)是表征物质在外磁场中被磁化程度的物理量。脑组织具有弱抗磁性,分散磁场;而空气由于含氧量的缘故,具有轻微的顺磁性,集中磁场。一些脑区靠近空气空间,例如下额叶区域(靠近鼻窦)和外侧颞叶区域(靠近气管)。匀场(Shimming)顾名思义就是要使磁场的强度均匀,提高信噪比,不然探测得到的信号会随磁场变化有波动。匀场线圈产生的磁场相当平滑,无法完全补偿磁化率急剧变化区域的磁场不均匀性。图5显示了剩余的不均匀性将如何导致图像中的几何失真。在非EPI(回波平面成像)采集(如T1加权和T2加权)中,失真在读出方向。而在EPI采集(如扩散MRI)中,则沿着相位编码方向进行。由于这些几何失真,根据读出(EPI相位编码)梯度或等效的场偏移信号(图5c,d),显示皮质的压缩或拉伸。失真的大小与读出带宽(EPI中的回波间隔)成反比。
图5:采集参数对解剖结构的影响
从左到右,( a)眶额区和(B)侧颞区的B0磁场分布图显示了磁场的巨大不均匀性。(c,d)FLASH scans中读出梯度的极性从(c)正变为(d)负,从而导致失真方向的改变。红色箭头:改变读出梯度的极性导致在c中没有明显的皮层,但在d中有相当厚的皮层。(e,f)当在扩散图像中改变相位编码方向的极性时,这种影响甚至更显著;红色箭头指向额叶皮层拓扑结构的巨大变化。
非线性梯度。设计具有高梯度强度和高回转率(峰值梯度强度除以达到该强度的时间)的梯度系统,同时最大化空间线性度和最小化涡流(即漩涡)是一项挑战。线性度总会受到一定程度的影响。对于所有的成像序列,非线性梯度都会导致图像的几何失真。由于非线性是梯度系统设计的一部分,不会随患者而变化,并且在提供梯度设计的详细信息后,可以进行校正。
化学和/或脂肪转移。磁自旋进动(改变旋转轴的方向)的速率与其所经历的磁场成正比,进动频率编码包含自旋组织的位置。在生物组织中,最常见的是水中的氢原子核(质子)。水质子的进动频率高于脂质中的质子。这种进动频率的差异被称为化学位移。由于仪器调节的是水中的氢原子核,而脂质中的氢原子核以“错误”频率共振,即接收信号的频率不能正确反映空间起源。结果是,相对于水信号,图像中的脂肪信号发生偏移。与B0场不均匀的区域一样,脂肪偏移与读出带宽成反比。在较低的频带宽度下,眼眶脂肪或头皮脂肪可能会完全移位,与皮质重叠,这会混淆形态计量学研究。可以通过使用窄带或复合“水激励”射频脉(仅激发水自旋)冲来改善脂肪信号,或者通过使用抑制脂肪信号的饱和脉冲来改善脂肪信号。
RF(B1)不均匀性。射频脉冲提供了扰乱自旋的能量,然后自旋在弛豫过程中释放出这种能量。“翻转角”(flip angle),在射频脉冲的激励下,层面内的宏观磁化矢量偏离静磁场方向的角度,它用带有横向和纵向分量(分别与B0场垂直和同轴)的矢量来描述产生的磁化。理想情况下,在射频脉冲期间,接收线圈内的所有自旋应经历相同的发射场(B1+)。实际上,B1+场并不是完全同质的,当RF波长越接近成像区域,场强越高,不均匀性越严重。在头部,这种效果会使图像中心变亮,对应于头部的不同翻转角。请注意,如果存在多种组织类型,结果不仅简单地缩放图像的强度,而是图像整体对比度的变化。因此,简单的乘法强度归一化不能完全纠正这种效果。一种方法是弛豫映射参数,考虑B1+map。理想的是实现均匀的B1+场,通过并行传输方法可以改善B1+均匀性,在并行传输方法中,结合了多个传输线圈的贡献,以实现均匀的合成场。由于组合是相位敏感的,,因此必须非常小心,以避免产生射频能量“热点”。RF能量随后在自旋弛豫过程中从成像物体发射。接收线圈捕捉该能量作为测量信号,用于生成图像。多个接收元件可提高接收信号的信噪比,并加速图像采集。然而,多通道接收线圈会导致射频接收场(B1–)不均匀。这种不均匀性会导致图像强度的缩放,可通过B1映射图进行校正。最佳情况下,在形成组合图像之前,应通过将对每个线圈元件与线圈灵敏度曲线加权来进行校正。
硬脑膜。人脑和脊髓被三层膜包围,统称为脑膜。在硬脑膜、蛛网膜和软脑膜中,厚的硬脑膜会干扰对皮质体积和厚度的估计。虽然硬脑膜的MR特征与灰质截然不同,但是在T1加权结构成像序列中,硬脑膜的T1、T2和质子密度(PD)值导致其与灰质接近,成等信号。由于硬脑膜与皮质的紧密相贴,仅通过T1加权MRI评估皮质厚度核体积时,不可避免地收到硬脑膜的干扰。在图6中,我们可以看到在许多位置中,硬脑膜与皮质灰质紧密相贴,因此很难分辨这两种组织,非常容易将硬脑膜标记为灰质。这可能导致高估皮质厚度和体积,更重要的是,当患者的灰质回缩使硬脑膜能够与皮质区分开来,而在健康对照组中硬脑膜没有被区分开时,会高估神经退行性疾病的萎缩率。
幸运的是,硬脑膜具有短的磁衰减特性T2和T2*,因此,即使稍微增加回波时间,也可以从视觉上将其与相邻灰质区分开来。但是,简单地延长回波时间(TE)不是T1加权扫描的最佳策略,因为灰白质对比度会随着TE的增加而降低。最佳方法是使用多回波采集(T2*信息被编码在多个回波中),或者获取带宽、读数和/或几何匹配的T2加权扫描(硬脑膜将明显比皮质暗)。
图6:硬脑膜和皮质
380μm×380μm×1mm图像(7次扫描,每次9分钟,运动校正T1=900毫秒;TR=2250,TE=4.35,flip=9°;3T;32通道阵列)突出显示硬脑膜及其与(a)外侧皮质和(b)内嗅皮质的接近程度。
空间标准化和图像处理。采集完成后,图像处理管道既可提取关键指标,又可识别受试者之间相应的空间映射,如上文所述(如图2和图3所示)。虽然累积的计算误差会增加噪声,但在识别空间同源性时,可能会出现问题。在粗略的空间尺度以及皮层下区域中,很容易识别和计算受试者之间的对应关系。一个更基本的问题是,大脑皮质和小脑皮质的复杂折叠模式(有足够的分辨率),因为任何两个皮质之间都没有1:1的同源性。脑沟的形态因皮层而异。仅举一个例子,一些受试者的内侧颞叶有一个分支的副沟,大约三分之一的受试者有两个分支的副沟,大约五分之一的受试者有一个中断的副沟。此外,分支模式与周围区域的体积有关。当受试者之间存在不同的分支模式,并且它们存在于许多皮质沟中时,通常不清楚如何在受试者之间正确地点对点匹配,更不用说创建正确的计算算法了。这对于VBM来说是一个问题。
有多种方法可以解决基于体积的配准的问题。第一,是承认基于体积的配准错误是一种信号形式(即,灰质密度的群体差异可能是由不同的皮质折叠模式,而不是真实的灰质数量造成的),VBM中的一个发现指示了在哪里可以更详细地观察解剖变化。第二,明确对齐皮质折叠模式可显著改善定位。最佳例证是,经过基于体积或表面的配准后,Broca区(基于神经元类型和分布的皮层细分)的跨受试者对应性。即使是基于表面的配准,也不能完全解释折叠模式的差异。第三,明确映射脑沟形状。识别和研究脑沟的最著名的一套算法在BrainVISA中。在这里,可以研究规模、位置、分支模式等,并在不同群体或其他感兴趣的指标之间进行比较。归根结底,这些方法是互补的,与采集伪影一样,理解混淆因素对最终结果的影响,是更好地使用结构脑成像技术的关键。
结构成像:当前的可能性
超高场强(例如7T)为提高基线信号(提高信噪比)提供了一条途径。但需要付出代价,尤其是对于受T2弛豫时间缩短、射频场均匀性变差、射频功率沉积增加、磁化率增加和失真影响的图像采集。在更高的磁场中,实施扩散和快速采集等方法是一项挑战。然而,正确地平衡这些因素,可以获得高质量和高空间分辨率的数据。超高场也可能对某些模式产生变革性影响。定量磁敏感图就是一个例子,7T磁场可增加对比度,即使在较小的皮质下核团中,也可通过全脑定量磁敏感图和更高的空间分辨率生成铁沉积成像。
同时,多通道接收线圈阵列可以提高信噪比,并可以同时采集多个层面。将成像的体积范围分成一组等距层面,每个层面驱动线圈子元件中的高信号。然后,可以同时捕获层面,并且可以使用各线圈元件的空间灵敏度来分离来自不同层面的信号。这种同时进行的多层(或多波段)采集缩短了扫描全脑所需的时间,目前可是扩散MRI的扫描时间加速2到5倍,转化为更高的空间和/或角度分辨率和/或单位时间的信噪比。在不同的研究项目中(the adult Human Connectome Project, UK Biobank以及 the developing Human Connectome Project),多波段采集对于数据质量至关重要。
现代临床扫描仪配备了梯度系统,可以提供更大的空间磁场梯度Gmax(~80 mT/m,而不是40 mT/m)。在扩散成像中,梯度强度越高,水分子的扩散程度越大。此外,精准控制梯度强度和持续时间的实验(集中在参数q中),可以测量扩散位移的微小差异,从而估计组织的特定微观结构特征。此外,与全身梯度系统相比,紧凑的头部梯度集允许快速切换梯度(即更快的“转换速率”)。这些特性可为扩散成像的准备,提供更短、更强的梯度脉冲,这在许多方面都是有益的,包括更高的信噪比、空间分辨率和角度对比度,因此在技术上需要更短的梯度的更精确的q空间测量。最近开发了超高Gmax磁共振系统,例如Connectome Skyras,它使用100和300 mT/m,提供极高的数据质量。这种硬件功能在绘制动物微观结构方面非常有益,有望转化为人类研究。
前景
在图像获取、图像处理和建模方面的进步,将确保结构成像在理解大脑-行为关系以及它们在发育、衰老和疾病中的变化方面,处于领先地位。
扩散MRI研究的一个主要焦点是微观结构模型,它超越了由张量衍生的指标,例如FA的本质是非特异性的。例如,FA的减少与结构和/或“完整性”的丧失有关,而FA的增加可能表明退化。在具有复杂纤维模式的区域,某种纤维群的选择性退化可明显增加结构的连贯性;剩下的纤维群在宏观上看起来更“有条理”。
更复杂的生物物理模型以及精准的测量,可以更精确地解释测量的信号,并通过提供微观结构变化的特定标记来帮助解释。例如,在q值范围内(梯度区域)测量的扩散信号显示出一种特征性的衍射模式,其中零交叉点表示亚细胞结构的大小。已在高性能扫描仪的非生物模型中,进行利用这些扩散测量估计微观特征(如亚细胞结构的形状和大小)。这种方法可能通过测量垂直的白质纤维束来估计轴突的平均直径。然而,在实践中,这种衍射图无法用标准(单脉冲)扩散序列或现有硬件进行测量。此外,这些模型会忽略体素内纤维的异质性,可能会驱动类似于间隔形状的信号特性。最近的一种方法旨在估计每个轴突的扩散率和各向异性(微观各向异性),它们本质上不受取向同质性和异质性假设的影响,只关注感兴趣的微观特征。由于零交叉的衍射测量对成像系统的异质性具有鲁棒性,改变用于扩散编码的梯度,主要涉及双重扩散编码方法,如双脉冲扩散增敏或振荡梯度,为估计间隔形状和大小提供了替代方法。这种序列也有望更好地描述扩散,并探测灰质体素或复杂交叉白质束中的各向异性(参见Box1和图4)。它们甚至可以捕捉扩散交换,是一种依赖于细胞膜通透性的参数。虽然这些方法具有巨大的潜力,但如要转化为活体人体成像仍然受到MRI扫描仪硬件和测量技术的限制,但技术正在迅速改进,并可能在未来实现突破。扩散成像技术的这些改进将有助于实现更好的纤维束成像,从而改善对信号源的定位。
随着方法的进步、对MRI伪影的理解及其影响的减少,神经解剖学研究的未来非常值得期待。理解我们的大脑如何变化(发育及衰老过程的变化),仍处于初步阶段。将高分辨率解剖图像的体积、厚度等估计值与多种微观结构模式相结合,包括双扩散编码方法、磁化转移、磁敏感加权成像以及定量T1和T2图,是非常有前景的方法。将活体人体成像与实验模型及其所有基因和分子工具相结合,也将提供新的见解。最终,我们不仅要绘制出在哪里发生了什么情况,还要理解信号的潜在分子和细胞基础。
此外,大脑结构为多种神经科学研究提供了一个的共同框架。近年来,全面且公开的人类脑组织图谱激增,这些图都是以解剖学为基础的,均包含了大量的表型维度。如基因表达的空间图谱(the Allen Brain Atlas, http://www.brain-map.org/)、细胞结构的空间图谱(http://www. http://fz-juelich.de/JuBrain/EN/_node.html )以及认知关联的空间图谱(http://neurosynth.org)。这些不同模式的图谱所表明,结构神经成像只是大脑建模的众多方法之一,也强调了解剖学作为共同的空间框架的重要性,大脑的所有其他表型属性都可嵌入这个框架。几项较新的研究证明了该观点,这些研究使用结构神经成像数据来计算不同脑区之间的物理距离,然后证明这些基于距离的方法可以预测人脑的功能连接、新陈代谢、基因表达以及认知关联。因此,通过结构神经成像在体测量大脑组织,不仅具有高度的信息量和鉴别表型,而且还描述大脑进化、发育和运作的基本解剖构架。