5+共病+MPL网络生信思路
今天给同学们分享一篇共病+网络药理学的生信文章“Exploring the common pathogenesis of Alzheimer’s disease and type 2 diabetes mellitus via microarray data analysis”,这篇文章于2023年2月27日发表在Front Aging Neurosci期刊上,影响因子为5.738。

阿尔茨海默病(AD)和2型糖尿病(DM)在现代社会中的发病率不断增加。尽管越来越多的证据支持DM易患AD,但其相互关系机制仍未完全阐明。
1. 差异表达基因的鉴定
图1展示了本文的思想。相关性分析后,对微阵列结果进行标准化处理(图2A,B、3A,B)DEG(GSE97760中的8091个和GSE95849中的3004个)(图2C,D、3C,D)。在排除GSE95849之间在GSE97760中具有相反表达趋势的基因后,获得了339个常见的DEG(97个下调,242个上调)(图4A)。在DEGs分析中,GSM527027被视为异常样本,因此在随后的分析中删除了该样本(图3A:a1、a2、B:b1、b2)。
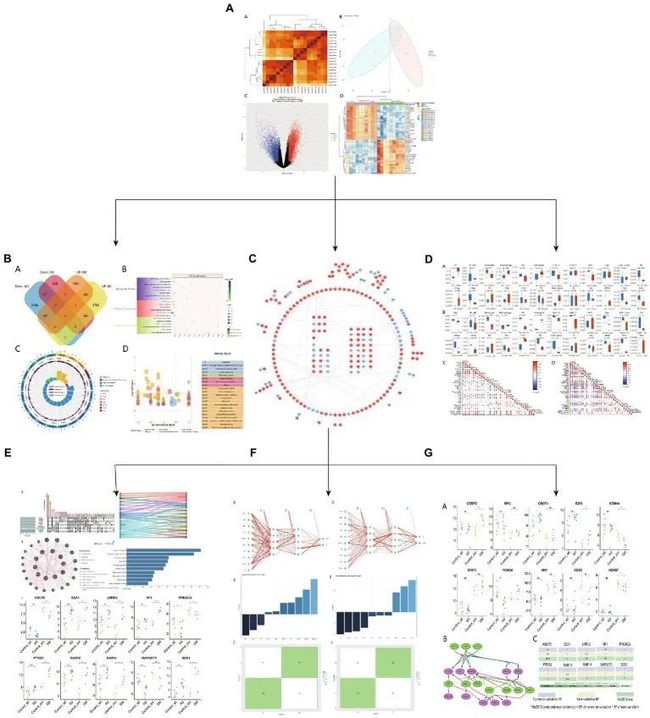
图1 研究设计流程图
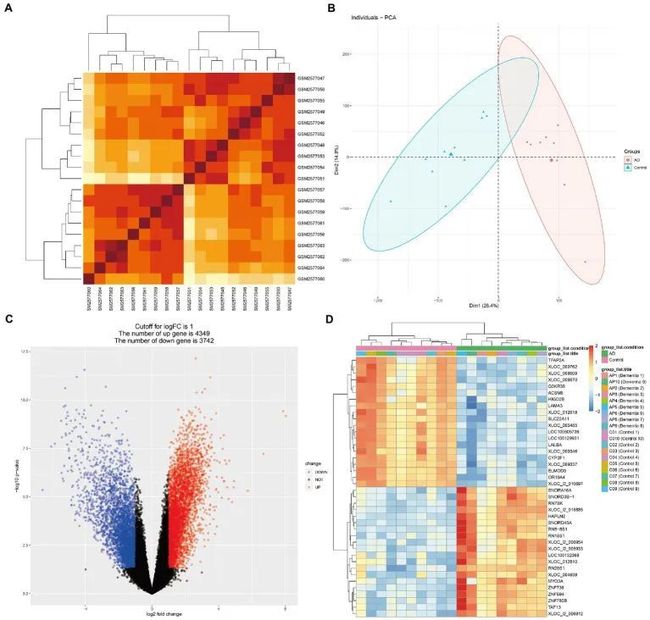
图2 AD组的微阵列标准化和差异基因分析
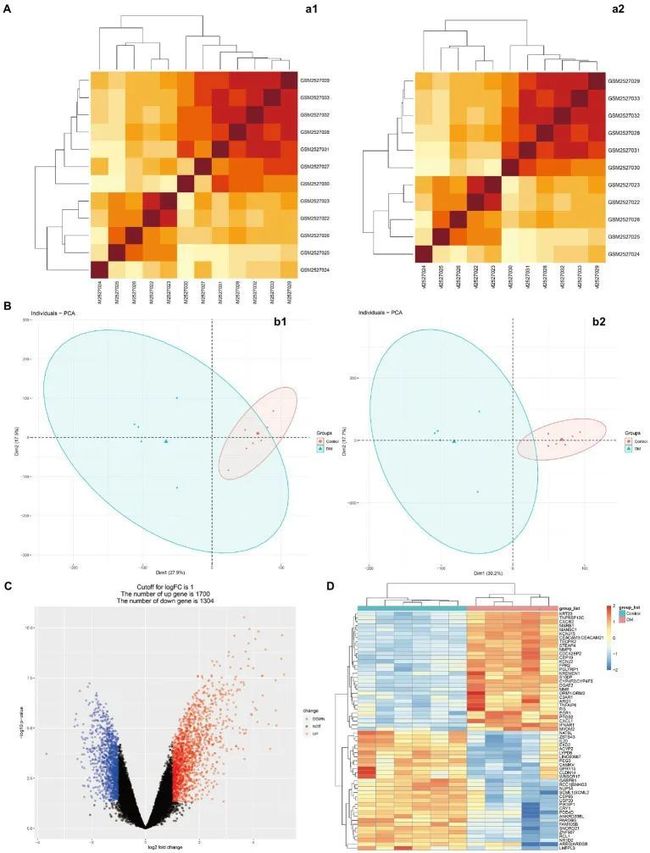
图3 DM组的微阵列标准化和差异基因分析
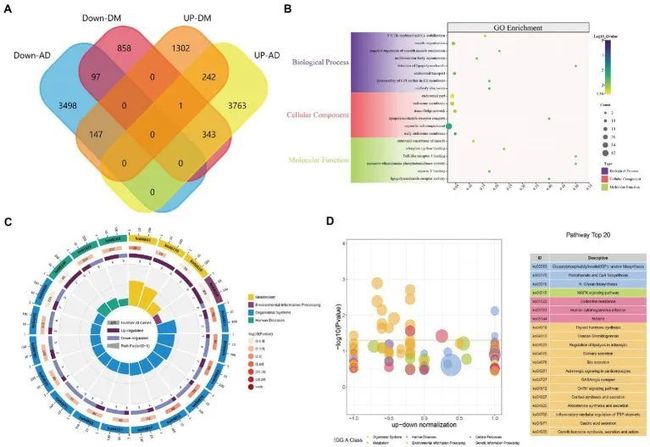
图4 DEGs富集分析结果
2. 常见差异表达基因(DEGs)功能特征分析
GO功能和KEGG通路富集分析被用来分析339个共同差异表达基因(附表S1)所涉及的生物功能和通路。GO分析结果显示,共有4,236个生物过程(BP),包括3'-UTR介导的mRNA稳定、囊泡组织、细胞分裂过程和星形胶质细胞发育;567个细胞组分(CC),涉及内体部分、脂多糖受体复合物、Wnt信号体和磷脂酰肌醇甘酰转移酶I复合物;720个分子功能(MF),如肌肉结构成分、Toll样受体4结合、脂多糖受体活性和Toll样受体结合(图4B)。KEGG通路包括有机体系统、代谢、环境信息处理和人类疾病。代谢方面的三个重要富集途径是糖基生物合成和代谢、辅因子代谢、糖基生物合成和代谢;机体系统中富集了甲状腺激素合成、卵巢类固醇合成和脂肪细胞脂解调节;环境信息处理中发现了MAPK信号通路、cAMP信号通路和Hippo信号通路;人类疾病中包括内分泌耐药性、疟疾和军团菌病(图4C,D),这些结果表明,炎症、激素、细胞因子和糖类共同参与了AD和DM的发生和发展。
3. PPI网络构建和小分子药物预测
PPI网络包含233个节点和286个相互作用对(图5)。将DEGs输入CMap数据库以通过连接性预测可能逆转两种疾病病理的小分子化合物。为了探索这种方法的可行性,作者在Drugbank中搜索了两种疾病的批准药物,并获得了10种AD药物和52种DM药物。有趣的是,在CMap的结果中,有7种AD药物与得分范围为-0.9247至-1.3658匹配;同样,有27种DM药物与得分范围为-0.6906至-1.0733匹配。在7,952个负相关的小分子化合物中,前10个小分子的得分范围为-1.6824至-1.8921,明显低于两种疾病的列出药物,表明这些小分子具有逆转两种疾病病理的潜力。
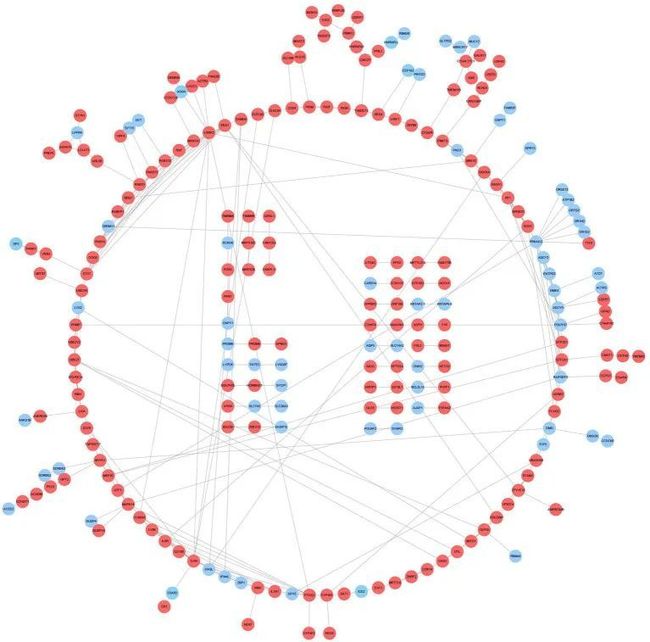
图5 PPI网络和常见的DEGs
4. 免疫浸润分析
检测微环境对临床治疗敏感性和疾病诊断具有重要的参考价值。在研究免疫浸润与基因矩阵之间的关系后,作者进一步探索了影响这两种疾病进展的基因的潜在分子机制(图6)。结果表明,AD组的单核细胞、NKT细胞、Tr1细胞、iTreg细胞、Tcm细胞和Tem细胞的比例明显高于普通患者。相比之下,许多细胞的比例低于正常患者,如DC细胞、中性粒细胞、nTreg细胞和CD8_navie细胞(图6A)。然而,在DM组中,免疫浸润的情况表现不同。与普通患者相比,中性粒细胞在DM组中显著增加,而单核细胞、iTreg细胞和iTreg细胞显著减少,其他显著减少的细胞包括NK细胞、CD4_T细胞、CD8_T细胞、Tgd细胞、CD4_navie细胞、nTreg细胞、Tfh细胞和CD8_naive细胞(图6B)。以上结果反映了不同疾病的细胞免疫微环境的差异。

图6 免疫浸润分析
5. 选择和分析关键基因
根据cybHubba的九种算法特征,作者分别得到了前30个中心基因(附表S4)。值得注意的是,这些中心基因共享10个靶点,包括七个上调基因(PTGS2、RAB10、LRRK2、SOS1、EEA1、NF1和RAB14)和三个下调基因(ADCY5、RAPGEF3、PRKACG)(图7A)。表1显示了相关功能的全名和中心基因。基于GeneMANIA数据库,作者得到了一个复杂的蛋白质相互作用网络,其中包括59.87%的共表达、31.95%的Reactome、7.09%的物理相互作用和1.10%的通路。GO分析涉及对胰高血糖素的反应、对肽激素刺激的细胞反应、cAMP代谢过程、胰岛素分泌、神经递质分泌的调节、对金属离子的细胞反应以及激活细胞表面受体信号通路的先天免疫反应。这些Reactome的结果强调了免疫系统和胰岛素在AD和DM中的关键作用(图7B)。此外,使用WebGestalt进行的通路分析与血清素能突触、卵巢类固醇合成和雌激素信号通路、脂肪细胞中脂解的调节以及人类巨细胞病毒感染相关(图7D)。有趣的是,两个基因(ADCY5和PRKACG)几乎涉及了所有前10个KEGG通路(图7C)。因此,神经递质、胰岛素、免疫和性激素在这两种疾病的发展中起着重要作用。图7E显示了10个中心基因的mRNA表达情况。
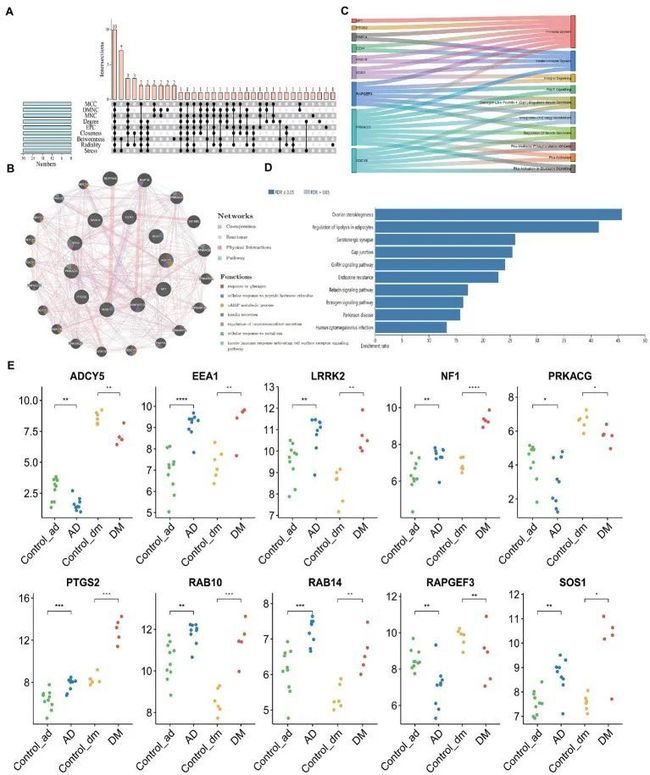
图7 Hub Gene的获取和共表达网络分析
为了探索Hub基因对疾病免疫浸润的贡献,作者进行了相关性分析。对于AD患者,EEA1、LRRK2、NF1、PTGS2、RAB10、RAB14和SOS1与免疫浸润评分显著正相关,而ADCY5和RAPGEF3与免疫浸润评分显著负相关(图6C)。而在DM患者中,只有PTGS2与免疫浸润评分显著正相关(图6D)。
此外,作者建立了具有两个隐藏层和每个隐藏层中五个神经元的多层感知(MLP)网络。对于获得的mlpcla模型,可以使用plotnet函数可视化模型的网络结构。运行程序后,可以获得图8所示的图像。在网络中神经元之间的连接权重中,正重要性使用红线表示,负后果使用灰色条纹表示,线的粗细反映了权重的大小(图8A,D)。对于MLP网络,可以计算和可视化每个独立变量对模型预测结果的重要性。作者的研究发现,对于AD分类,最重要的三个正向变量是PRKACG、RAPGEF3和LRRK2。而EEA1、RAB14和NF1是三个负权重变量。对于DM分类,最重要的三个正向变量是PRKACG、RAPGEF3和RAB14。
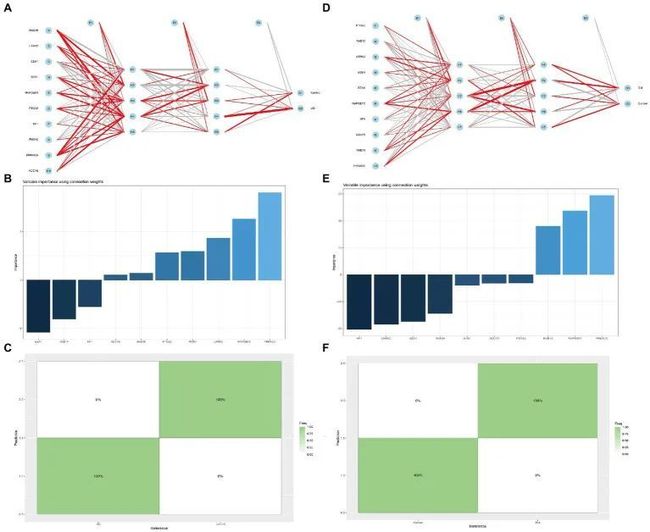
图8 多层感知网络分析
类似地,负权重为NF1、LRRK2、EEA1等(图8B,E) E.MLP分类器对数据集的预测效果也可以使用混淆矩阵来可视化。如图8所示,AD和DM的种子可以在混淆矩阵中找到,可以100%正确预测(图8C,F)。
有趣的是,在查询AlzData后,作者发现RAPGEF3与Aβ和Tau显著正相关,而NF1与Aβ和Tau显著负相关。此外,作者还使用了Attie实验室的糖尿病数据库,发现ADCY5和SOS1与胰岛素和体重显著正相关,但与葡萄糖显著负相关;相反,PTGS2和EEA1与葡萄糖显著正相关,但与胰岛素和体重显著负相关。累积的流行病学和生化证据表明,脑内胰岛素抵抗导致大鼠海马和前额叶皮质的基因表达谱发生改变,暗示了2型糖尿病和阿尔茨海默病之间的关联。GSE34451数据集包含了来自2型糖尿病Goto-Kakizaki大鼠和对照动物的每个脑区样本的三重复制品,为最近阐述的阿尔茨海默病是第3型糖尿病的理论提供了进一步的实验证据。与正常组相比,海马中的EEA1、NF1和RAB14显著上调。皮质中的ADCY5和RAPGEF3显著下调,纹状体中的LRRK2、RAB10和SOS1显著下调,NF1显著上调。已经证明,T2D db/db小鼠在短期和空间工作记忆方面与db/m小鼠相比存在缺陷。使用GSE151294数据集对T2D db/db小鼠的海马组织进行微阵列分析,发现海马中的EEA1和LRRK2显著下调,而NF1显著上调。
上述的验证结果与作者的生物信息学分析结果有些不同,这可能是由于所测试的物种和对象不同所致。本文研究了DM和AD的人类血液转录组学,并使用动物脑组织作为验证样本,但最终结果对作者是有利的。例如,在血液中,NF1、RAB14、ADCY5和RAPGEF3的mRNA表达趋势与脑病相同,这表明通过检测与血液相关的指标可以实现评估脑状态的目的。
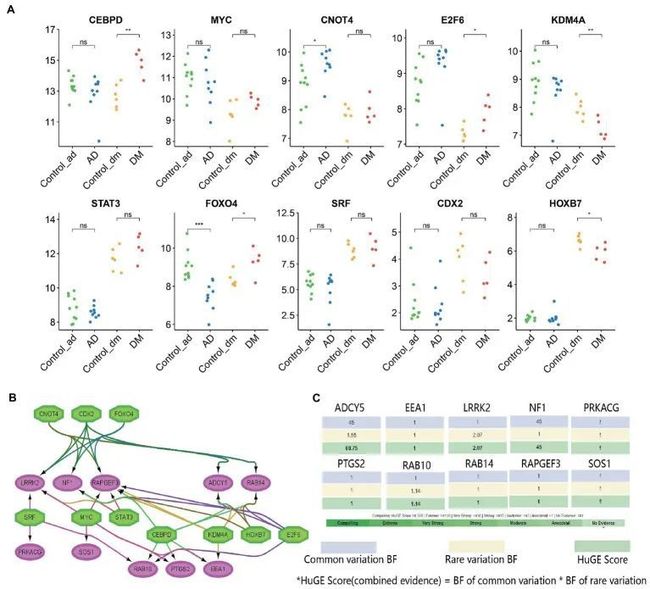
图9 预测和验证转录因子
基于iRegulon作者发现10个转录因子(NES ≥ 5)可能调控中心基因的表达(图9A)。进一步验证表明,CEBPD,E2F6和FOXO4在DM组中显著上调,而KDM4A和HOXB7显著下调。类似地,CNOT4在AD组中显著上调,但FOXO4显著下调。它们共同调控着10个中心基因(图9B)。
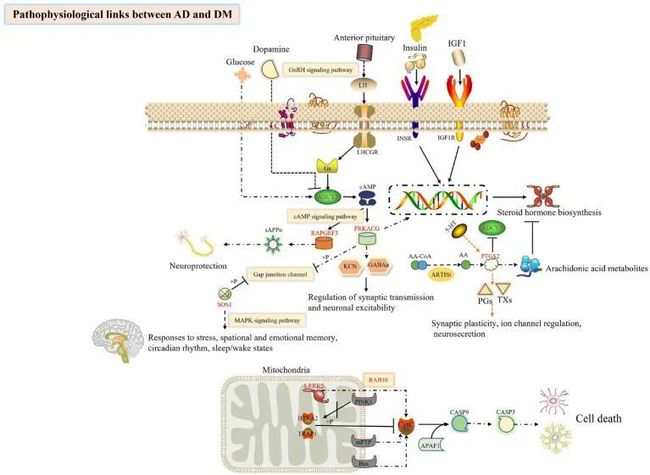
图10 通过生物信息学分析探索与DM并发AD的发病机制相关的中心基因
总结
总之,作者探讨了AD和DM可能的差异表达基因(DEGs),并进行了常规的生物信息学分析和蛋白质相互作用网络构建。正如作者所预期的那样,AD和DM共同贡献了各种常见的致病机制,这可能是由个体中心基因自愿发生的。葡萄糖稳态和脑功能的变化,NF1、RAB14、ADCY5和RAPGEF3可能成为后续研究的重点。迄今为止,关键基因与AD和DM的免疫浸润之间的联系很少被报道。关键基因是否具有临床诊断意义,以及与免疫浸润相关的因素是否有助于AD或DM的诊断,仍有待探索。本研究为继续探索DM伴随AD或其他疾病的分子机制提出了一个新的概念。