8+单基因泛癌+甲基化+实验
今天给同学们分享一篇单基因+泛癌+甲基化+实验的生信文章“Integrated pan-cancer analysis and experimental verification of the roles of tropomyosin 4 in gastric cancer”,这篇文章于2023年3月13日发表在
Front Immunol期刊上,影响因子为8.786。

全球范围内,胃癌在发病率上排名第五,在死亡率上排名第三。早期肿瘤可以通过内窥镜手术或根治性胃癌手术切除。然而,由于胃癌具有高度侵袭性,大多数被诊断出患有胃癌的患者表现出晚期胃癌进展,并且很可能正在接受氟尿嘧啶和铂类化疗治疗。分子靶向药物,如曲妥珠单抗(抗人表皮生长因子受体2,HER-2)和尼伐替尤单抗免疫疗法(抗程序性细胞死亡蛋白1,PD-1),逐渐改善了患者的预后,但并非所有情况都适用。因此,迫切需要确定新的预后生物标志物和分子靶点,以预测胃癌患者的预后并指导个体化治疗。

图1 流程图
1. TPM4表达水平及其亚细胞定位
HPA数据集显示TPM4在泌尿生殖系统、呼吸系统和消化系统中的表达排名靠前(图2A)。TCGA和GTEx数据集显示TPM4在BRCA、CHOL、COAD、DLBC、ESCA、GBM、HNSC、LAML、LGG、LIHC、LUCS、OV、PAAD、PCPG、PEAD、READ、SARC、STAD和TGCT中显著上调(P < 0.05)。相反,TPM4在BLCA、KICH、KIRP、LUAD、PRAD、LUSC、SKCM、THCA、THYM、UCEC和UCS中下调(P < 0.05)(图2B)。GEPIA2的数据集显示PAAD和SKCM与肿瘤分期显著相关(P < 0.05)。根据TCGA数据集分析的结果,TPM4在BLCA、BRAC、CHOL、COAD、ESCA、HNSC、KICH、KIRC、KIRP、LIHC、LUAD、PRAD、STAD和UCEC的肿瘤组织和配对正常组织中表达差异显著(图2C)。观察到TPM4在肌动蛋白丝(图2D)和细胞质(图2E、F)中的亚细胞定位。因此,作者的结果表明TPM4在大多数肿瘤中上调,并且在STAD中高于配对(非配对)正常组织的表达水平。

图2 TPM4的表达水平和定位
2. TPM4表达与泛癌预后和诊断的相关性
根据森林图和Cox评估的结果(图3A),TPM4是ACC、CESC、CHOL、DLBC、ESCC、HNSC、KIRC、KIRP、LIHC、LUAD、LUSC、MESO、PAAD、STAD、UCEC和UVM的总体生存不良因素(P < 0.05,HR > 1),而在COAD、COADREAD、OS和PCPG中可能是有益因素(P < 0.05,HR < 1)。此外,作者重点关注TPM4表达与消化系统恶性肿瘤的关联,TPM4高表达与LIHC(图3D,p = 0.02)、ESCC(图3E,p = 0.028)、PAAD(图3F,p < 0.001)和STAD(图3G,p = 0.018)的不良预后显著相关。值得注意的是,在COAD(图3B,p = 0.04)和COADREAD(图3C,p = 0.009)的情况下,低TPM4表达的患者预后比高TPM4表达的患者更差。接下来,作者使用ROC曲线评估TPM4在消化系统癌症的诊断效能。TPM4在预测COAD(AUC = 0.807)(图3H)、COADREAD(AUC = 0.837)(图3I)、ESCA(AUC = 0.725)(图3J)、LICH(AUC = 0.739)(图3K)和STAD(AUC = 0.795)(图3L)方面具有一定的准确性。TPM4表达在预测PAAD(AUC = 0.972)(图3M)。总的来说,TPM4的表达在不同的癌症中,包括胃腺癌,在诊断和预后方面具有价值。

图3 TPM4表达与泛癌预后和诊断的相关性
3. 遗传改变分析
作者在cBioPortal上调查了TPM4在泛癌遗传变异。如图4A所示,TPM4表达在来自2565名不同癌症类型患者的131个样本中发生了变异,占样本的5%。TPM4的突变率在32种癌症类型中观察到,如图4B所示。最高的突变率(>60%)在卵巢癌症例中观察到。在包括胃癌在内的24种癌症中没有观察到较高的突变率。在胃癌中,最常见的变异类型是拷贝数变异(CNV)中的“突变”和“扩增”。随后,如图4C所示,作者调查了TPM4中推测的拷贝数变异(CNA)与泛癌组织中TPM4 mRNA表达的相关性。在胃癌中,鉴定出了15个突变基因,它们在TPM4高/低表达群体的突变谱中。前5个基因是ABCA12、DOCK3、NALCN、PCDH17和KRAS(图4D)。

图4 基因改变分析
4. 基因改变分析
作者评估了TPM4在正常组织和19种癌症组织中的启动子DNA甲基化水平。在BRCA、CHOL、COAD、ESCA、HNSC、LUAD、PCPG、PRAD、THYM和UCEC中,TPM4的甲基化水平较高。相反,在GBM、KIRC、LICH、PAAD、SARC、STAD、TGCT和THCA中,它的甲基化水平较低(图5A)。随后,根据MethSurv数据库中TPM4的甲基化图谱,在STAD中确定了25个TPM4的CpG位点(图5B)。此外,mRNA修饰参数是表观遗传学的重要组成部分,参与了转录后基因调控。许多研究表明,mRNA修饰与癌症的进展和发生密切相关。m1A、m5C和m6A是常见的mRNA修饰类型。为了探索TPM4表达与45个mRNA修饰调节因子之间的相关性,选择了甲基转移酶(写入者)、去甲基酶(擦除者)和RNA结合蛋白(读取者)。如图6A-C所示,TPM4表达与大多数癌症组织中的m1A、m5C和m6A甲基化呈正相关。随后,在STAD中,前10个甲基化调控因子包括METTL14(m6A_writer; r=0.403, P < 0.0001)、YTHDF3(m1A_reader; r=0.421, P < 0.0001)、FTO(m6A_eraser; r=0.399)、TET2(m5C_eraser; r=0.375)、NSUN3(m5C_writer; r=0.374)、WTAP(m6A_writer; r= 0.368)、YTHDC2(m6A_reader; r=0.366)、CBLL1(m6A_reader; r=0.357)、FMR1(m6A_reader; r= 0.338)和YTHDC1(m1A_reader; r= 0.306)。以上结果表明,TPM4的表达与DNA甲基化和mRNA修饰在不同癌症中密切相关,包括STAD。
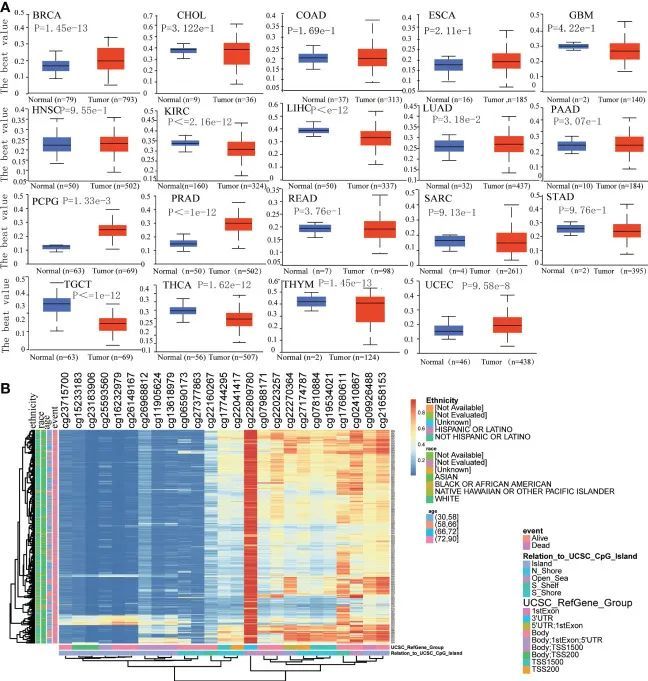
图5 TPM4的DNA甲基化分析

图6 TPM4表达与mRNA修饰甲基化调控因子之间的相关分析
5. TPM4表达与免疫浸润
作者调查了TPM4表达与肿瘤微环境(TME)中免疫细胞浸润之间的关联。EPIC在线工具显示,八种与TPM4表达在不同癌症中相关的免疫细胞,尤其是在KIPR、LUAD、PCPG、PRAG、STAD和UVM中(图7A)。ESTIMATE评分对于确定肿瘤纯度和TME中的免疫细胞浸润非常有用。作者的研究结果显示,TPM4表达与STAD中的ESTIMATE评分呈正相关(图7B)。接下来,作者评估了TPM4高表达组和低表达组在STAD中CD8 T+细胞、嗜酸性粒细胞、巨噬细胞、NK细胞和Treg细胞中的富集分数。两组之间的富集分数显示出显著差异(图7C)。免疫检查点(ICP)基因被发现在免疫细胞浸润和免疫治疗结果中起到了作用。作者的结果表明,TPM4的表达与BRCA、CHOL、COAD、DLBC、ESCA、KICH、LGG、LIHC、LUAD、PAAD、PRAD、READ、STAD、THCA和UVM中这八个ICP基因(CD274、CTLA4、HAVCR2、LAG3、PDCD1、PDCD1、LG2和TIGIT)的表达呈正相关(图7D)。这表明TPM4通过不同的信号通路协调ICP基因的活动,并可能成为免疫治疗的关键靶点。TMB、MSI和NEO被认为是肿瘤免疫治疗反应的预测因子。此外,作者观察到TPM4的表达增加,并导致ACC、UCSC、GBM、PAAD和STAD中TMB的增加(图7E)。MSI与TGCT、SARC、ACC、UVM和STAD中的TPM4表达呈正相关(图7F)。TPM4的表达与ACC、TGTC、DLBC、PCPG和THCA中的NEO呈正相关(图7G)。总体而言,TPM4可能通过与免疫浸润细胞、ICPS、MSI、TMB和NEO在泛癌组织中的关联来影响抗肿瘤免疫。

图7 TPM4表达与免疫浸润的相关性分析
6. 在胃癌中构建lncRNAs-miRNA-TPM4网络
RNA22、DIANA-micro、miRWalk、miRcode和TargetScan被用于在STAD中识别TPM4的靶向miRNA,如图8A所示。作者分别从这些来源中鉴定出了7、24、2063、10和1230个TPM4的靶向miRNA。在三个数据库中预测出了41个共同的miRNA。为了进一步探索这41个miRNA的靶向lncRNA,作者使用了Starbase2.0,并发现了七个miRNA(hsa-miR-613、hsa-miR-338-3P、hsa-miR-206、hsa-miR-30e-5P、hsa-miR-30b-5p、hsa-miR-10b-5p和hsa-miR-299-3p)具有靶向lncRNA的能力。mRNA表达通常与miRNA表达呈负相关。TPM4表达与hsa-miR-30e-5P(图8B)、hsa-miR-30b-5P(图8C)、hsa-miR-338-3(图8D)和hsa-miR-206表达(图8E)呈负相关。lncRNA可以作为竞争性内源性miRNA进一步调控mRNA表达。作者还确定了四个负调控的靶向miRNA及其靶向lncRNA(图8F)。最后,作者构建了一个GC的lncRNA-miRNA-TPM4调控网络(图8G)。

图8 在STAD中构建与TPM4相关的关键ceRNA网络
7. TPM4相关药物的敏感性分析
CTPR数据集显示了TPM家族成员(TPM1、TPM2、TPM3、TPM4)mRNA表达水平与药物敏感性之间的相关性;与TPM4表达呈正相关的前三种药物分别是COL-3(环素类似物)、CR-1-31-B(eIF4A抑制剂)和GSK525762A(Bet抑制剂);(图9A;P < 0.0001)。根据GDSC药物敏感性结果,与TPM4表达呈正相关的前三种药物分别是5-氟尿嘧啶、AR-429(组蛋白去乙酰化酶抑制剂)和AT-7519(细胞周期依赖性激酶抑制剂),与TPM4表达呈负相关的药物分别是17-AAG(热休克蛋白90抑制剂)、博莱霉素(50 uM)、CHIR-99021(GSK-3α/β抑制剂)、多西他赛(图9C;P < 0.0001)。由于CTRP和GDSC药物敏感性预测结果中涉及的一些药物被用于科学研究,根据药物库的数据,FDA批准了基于TPM4相关数据的23种抗肿瘤药物(图9B)。作者使用CMap "qury"在线工具分析了TPM4高表达和低表达的差异表达基因(DEGs)。根据CMap数据库查询的结果,确定了包括ALK/BCR-ABL/BTK/CDK/Met抑制剂等在内的15种小分子药物,获得了8种针对TPM4的小分子药物,意味着它们具有治疗前列腺腺瘤的潜力。UVM、LUAD、KIRC、COAD、BRCA、HCC。值得注意的是,Rucaparib的绝对值得分最高,意味着该药物有治疗7种癌症的潜力(图9E)。Rucaparib是一种聚(ADP-核糖)聚合酶(PARP)抑制剂,用于治疗复发性卵巢和前列腺癌。

图9 TPM4相关药物在泛癌组织中的药物敏感性
8. 相对共表达的基因,以及对TPM4在STAD中的功能分析
作者从TCGA中确定了表达共同性的基因。热图显示了与STAD中TPM4表达呈正相关和负相关的前50个共表达基因(图10A、B)。与TPM4表达呈正相关的前100个共表达基因显示在PPI网络中(图10C)。前10个中心基因是COL1A2、COL1A1、CLO3A1、COL5A、POSTN、FN1、MMP2、LUM、SPARC和DCN(图10D)。前5个中心基因是COL1A2、CLO3A1、FN1、MMP2、LUM、SPARC和DCN(图10E)。随后,作者使用前300个共表达基因进行了GO和KEGG富集分析。GO分析涉及分子功能、细胞组分和生物过程(见图10F)。KEGG通路富集分析(见图10G)。结果显示,TPM4表达通过调节细胞外基质在胃癌中发挥作用。

图10 相关基因显示共表达,并对STAD中TPM4表达进行功能分析
9. TPM4敲低抑制细胞迁移和肿瘤侵袭
为了验证TPM4在胃癌中的功能,作者在实验室中使用了两种类型的胃癌细胞。数据显示了TPM4的mRNA(图11A)和蛋白表达水平(图11B)。在作者之前的研究中,经过shRNA慢病毒感染后,shTPM4的沉默效率为71.1%,TPM4的沉默抑制了胃癌细胞的增殖。在这项研究中,作者使用划痕愈合和Transwell实验来确定胃癌细胞的迁移潜力。TPM4的沉默抑制了AGS(图11C,P < 0.01)和BGC-823(图11D,P < 0.01)的迁移,这在划痕愈合实验中观察到。作者还发现TPM4的表达抑制了AGS细胞(图11E,P < 0.01)和BGC-823细胞(图11F,P < 0.01)的迁移。Matrigel Transwell实验显示,在TPM4沉默的情况下,AGS细胞(图11G,P < 0.01)和BGC-823细胞(图11H,< 0.01)的侵袭潜力显著降低。这些实验的结果表明,TPM4是一个促进胃癌肿瘤侵袭和细胞迁移的关键癌基因。
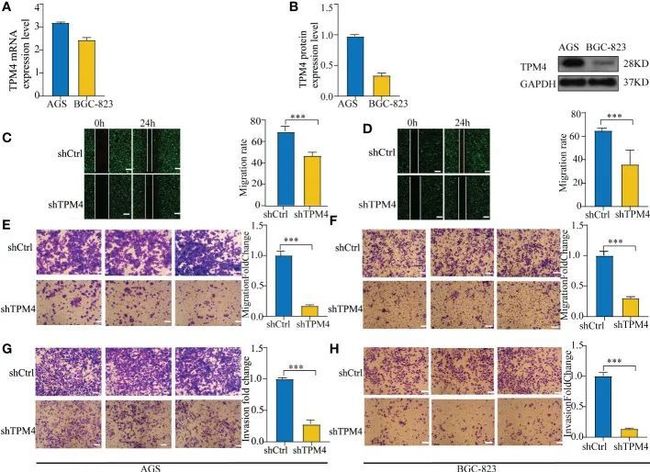
图11 TPM4的敲低抑制了细胞的迁移和侵袭能力
总结
TPM4在癌症中,包括胃癌,作为一个有前景的预后和诊断和免疫治疗的生物标志物。此外,TPM4表达与多西他赛和5-氟尿嘧啶敏感性相关。lncRNA-miRNA-TPM4网络调节胃癌进展的机制。TPM4作为一个癌基因和促进胃癌细胞侵袭和迁移的调节因子,可能通过细胞外基质重塑,需要进一步研究。