肠道3M:微生物群、代谢和代谢组,从基础走向未来
在过去的研究中,健康科学的突破表明人类肠道菌群可以受到环境因素的影响(饮食、生活方式等),而环境因素反过来又可以影响人类健康和疾病。
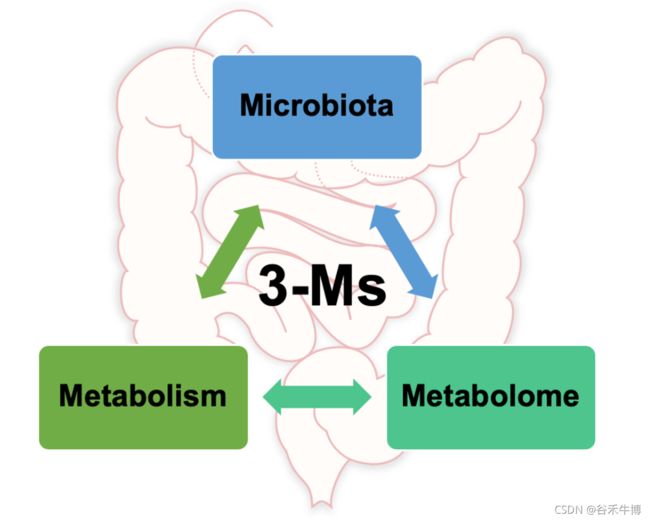
现在,更全新的概念肠道3M已经提出,即微生物组、代谢和代谢组(microbiota, metabolism, metabolome),对人类健康具有重要意义。
本文重点介绍3M相关的主要概念,提供了关于调节肠道健康的全面更新概述,有助于我们对肠道与人类健康和疾病之间的关系的基本理解。同时也定义了3M相互作用的挑战及讨论未来前景。
01 微生物群
在阐述微生物群之前首先了解一下它的发展历史。
关于微生物群的历史
Dey P, et al., Free Radic Biol Med. 2021
人类微生物群
随着下一代高通量16S rRNA测序技术的出现,与人类健康和疾病相关的以微生物群为中心的研究有了巨大的增长。
数量
目前的估计表明,一个体重为70公斤的人平均含有39万亿细菌,而人体细胞则为30万亿。此外,在遗传水平上,在整个人类微生物群中基因数量超过1000万个基因,比人类基因(2万-2.5万)还要多很多,仅肠道微生物群基因就有330万。由于与生命各个方面相关的宿主-微生物相互作用的数量巨大,人类微生物群关联通常被称为“超有机体”。
分布
肠道细菌在肠道长度上的定植偏好是区域特异性的,可能是由缺氧肠腔内宿主的理化参数的变化(如pH值、营养有效性、pO2、胆汁酸、抗菌剂、粘蛋白)决定的。此外,在肠的特定区域内,管腔和绒毛隐窝之间的微生物种群多样性可能不同。比如说,厚壁菌和拟杆菌在盲肠中占优势,而隐窝主要由变形杆菌门和脱铁杆菌门定植。
“核心微生物群”
当然,由于与环境的不同相互作用,包括饮食模式的差异,文献中的微生物概况往往不一致。因此,人类微生物组项目的一个关键目标是确定一个“核心微生物组”,作为所有个体的普遍微生物分类学特征,该特征大部分保持不变。
内部和人际微生物差异被划分为特定的“菌群”,这可能是由于生活史特征造成的,并且是个体特有的。
微生物群的变化(生命早期->衰老)
人体内的肠道微生物群不是静态的,可以随时间变化。首次接触微生物群发生在出生过程中。(少数新兴但有争议的研究声称在先前认为无菌的胎盘组织中检测到微生物,但最近发现胎儿胎粪中无法检测到微生物特征,这对先前研究提出了挑战)。
产前饮食影响微生物群
在怀孕期间,产前饮食会影响婴儿的微生物群结构,以及对肥胖、糖尿病、哮喘或高血压等疾病的易感性。怀孕期间水果摄入量的增加与阴道分娩婴儿链球菌/梭状芽胞杆菌感染率的增加有关。
分娩方式影响微生物群
阴道分娩的婴儿有更多的乳酸菌,而剖腹产的婴儿有较低的拟杆菌属和较高的梭状芽孢杆菌属。
婴儿期饮食影响微生物群
在婴儿期,肠道微生物的定植也受到饮食模式的影响。与补充配方食品的婴儿相比,母乳喂养40天的婴儿双歧杆菌和拟杆菌含量较高,但链球菌和肠球菌含量较低。
在3个月以内,母乳喂养婴儿的Lachnospiraceae和Clostridioides比配方喂养婴儿低,而在6个月时α-多样性比配方喂养婴儿高。
衰老过程中微生物群变化
在人的一生中,尽管许多因素(如饮食、药物、疾病)影响肠道微生物群,但一般来说,衰老与微生物多样性的下降有关,而微生物群的特定变化主要与特定拟杆菌、梭状芽胞杆菌、双歧杆菌和乳酸杆菌相关。
百岁老人和超级百岁老人的Christensenella、Akkermansia和双歧杆菌含量较高,这可能表明他们具有潜在的利于长寿作用。
另一些报道称,在没有肥胖、糖尿病、高血压和癌症等慢性疾病的百岁老人中,具有各种产石胆酸的odoribacteriaceae的数量增加,产丁酸菌Faecalibacterium prausnitzii和Eubacterium rectale的减少。
肠道微生物群的有益方面
在正常条件下,肠道微生物群被认为保持在平衡状态,在这种状态下,肠道微生物群具有对宿主有益的各种代谢功能。
肠道微生物与内分泌器官共同发挥作用,产生大量代谢物,作用于每一个肠外组织和器官。微生物群衍生的代谢物对宿主免疫、内分泌、神经元和代谢成分的巨大影响,肠道微生物群被称为“第二大脑”。这些功能包括必需维生素的合成、短链脂肪酸的生成、药物和植物化学物质的代谢、屏障功能的维持、血管生成的调节、免疫稳态的维持以及抵御病原体等。
丁酸盐是结肠细胞的首选能源,产丁酸菌(如双歧杆菌、厌氧菌、真杆菌和玫瑰杆菌)因其在限制粘膜炎症和维持肠道屏障方面的有益作用而被视为共生菌。
乳酸菌可以单独生产钴胺素,而双歧杆菌可以生产叶酸、维生素K、核黄素、生物素、烟酸、泛酸、吡哆醇等。
某些肠道细菌可以促进伤口愈合(如鼠李糖乳杆菌),促进上皮细胞完整性(如粘液阿克曼菌)和刺激粘液合成(如普氏粪杆菌)。肠道微生物群的一个重要作用是维持粘膜免疫稳态和限制粘膜炎症损伤。
肠道微生物群在形成宿主免疫系统中的关键作用来自以下证据:无菌(GF)小鼠的T淋巴细胞分化能力受损,分泌性免疫球蛋白A(sIgA)和抗菌肽分泌减少,IgE系统性增加,通过正常小鼠或人类供体的粪便移植,这些缺陷中的许多是可逆的。
此外,其他研究表明,人类的情绪、行为和总体幸福感也可能与肠道微生物群依赖性的免疫、内分泌和代谢信号调节有关。
肠道微生物群和饮食
个体间肠道微生物分布的差异可能取决于年龄、地理位置、种族和社会经济状况。然而,影响微生物群的最重要的潜在因素是饮食模式和营养成分,无论宿主基因型如何,饮食模式和营养成分都可以改变微生物群。
作为现代生活方式的一部分,由于从传统饮食转变为高度加工的饮食,导致了对祖先肠道微生物结构的偏离,这归因于疾病易感性。
微生物群的古今变化
尼安德特人粪便样本的肠道微生物分析显示,具有降胆固醇活性的细菌(双歧杆菌、普雷沃杆菌、乳酸杆菌、乳酸菌科)的数量增加,粪便中粪醇水平增加,粪醇是胆固醇氢化形成的代谢物。
此外,还发现了产短链脂肪酸的有效细菌,强调了植物性食品在人类进化中的重要作用。尼安德特人口腔中已发现支持碳水化合物降解菌(如链球菌)的流行,但程度低于现代人,表明随着现代化的发展,对以淀粉为基础饮食的依赖性增加。
模仿采猎者以全食物为基础、碳水化合物最少的饮食的古饮食能促进肠道微生物的整体多样性,促进碳水化合物非代谢微生物(如Sutterella和Odoribacter)的生长,以及喜欢脂肪、耐胆汁菌(如Bilophila)生长。
然而,也有人报告说,长期食用古饮食可能与血清中三甲胺N-氧化物(TMAO)水平高有关,TMAO是心血管疾病的危险因素。
饮食 & 菌群 & 体重
一般来说,高热量的肥胖饮食会增加微生物的能量获取能力。此外,肥胖相关的代谢表型,如BMI、脂肪积累和血清甘油三酯与具有较高能量收集能力的细菌(直肠真杆菌-球藻梭菌)相关。
人们普遍认为,与瘦的个体相比,肥胖个体具有更多的厚壁菌门和较低的拟杆菌门。事实上,长期低热量饮食,体重减轻25%的肥胖个体表现出厚壁菌的减少,而拟杆菌的数量增加。此外,从两个单独的队列中补充有异硫氰酸盐饮食(2400 kcal/天vs.3400 kcal/天)的临床观察表明,导致体重增加的热量摄入增加与厚壁菌与拟杆菌(F:B)比率的增加有关。
其他研究表明,热量限制可通过脱硫弧菌科、Hydrogenoanaerobacterium、阿克曼菌和瘤胃菌科的丰度改变来降低心脏代谢风险。因此,针对特定肠道微生物和恢复特定微生物群很可能有助于减轻肥胖和相关代谢组学疾病。
素食 & 肉食
以植物和动物为基础的饮食对肠道微生物群有不同的影响,以植物为基础的饮食诱导玫瑰杆菌、直肠真杆菌和瘤胃球菌的大量繁殖,而耐胆汁的微生物,如Alistipes、嗜胆汁菌和拟杆菌,仍然与以动物为基础的饮食相关。某些产短链脂肪酸菌,如Prevotella,在以植物纤维和碳水化合物为稳定饮食的非洲儿童中占主导地位。
营养摄入
营养不良个体的典型肠道微生物特征包括长双歧杆菌和假长双歧杆菌比例较低,肠杆菌科细菌增多,而微生物代谢特征通常包括较低的能量收集能力、较少的免疫保护和必需的维生素生物合成,以及致病因子的增加。
营养素摄入模式也会影响肠道微生物的管腔优势。竞争性生长实验的证据表明,母乳中的岩藻糖基低聚糖可诱导长双歧杆菌和拟杆菌选择性过度生长,从而超过大肠杆菌和产气荚膜梭菌等致病菌。肠道粘液层可支持肠道共生体(如Akkermansia muciniphila)的定植,该共生体可利用粘液作为营养源。
微生物群和慢性疾病
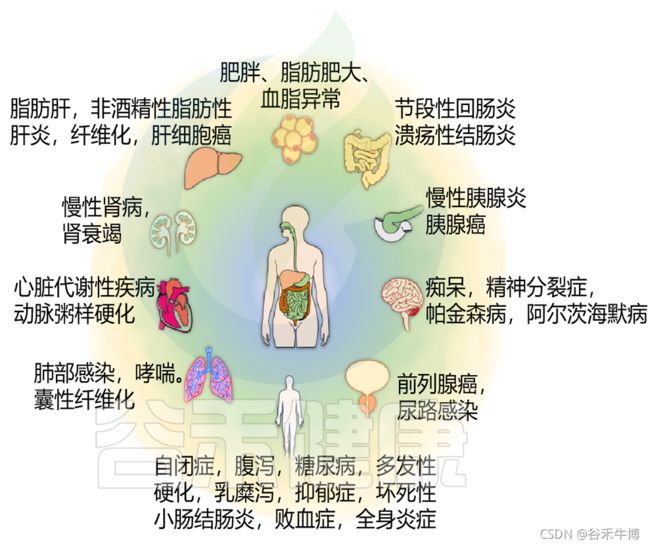
肠道微生物群几乎与各种人类疾病相关(下图)。
然而,肠道微生物群在触发慢性疾病中的作用在肥胖相关的慢性疾病中得到了最广泛的研究,如非酒精性脂肪性肝炎(NASH)、II型糖尿病和心脏代谢疾病。这可能是因为我们对肠道微生物群的大部分了解都是通过在临床前模型中使用高热量饮食的研究得出的,这导致了一系列代谢异常,主要发生在肠外组织,如脂肪、肝脏和心脏。
据报道,肠道微生物群通过多种方式影响慢性代谢性疾病的发病机制,包括调节宿主免疫代谢、非消化性多糖的肠道厌氧发酵、胆汁酸产生和胆碱代谢,影响饮食能量收集过程,产生内源性酒精,生物转化饮食中的植物化学物质和药物,并限制条件致病菌的定植。
有研究表明,微生物群调节饮食能量获取能力,增加能量储存,从而刺激体重增加。
肠道微生物群也可以促进代谢性内毒素血症,从而触发胰岛素抵抗。患有慢性代谢性疾病的受试者通常与产丁酸菌数量减少、嗜粘液阿克曼菌数量减少以及具有炎症潜能的细菌数量增加(如大肠杆菌)有关。
喂食有肝病和胰岛素抵抗的肥胖饮食的小鼠表明,与氨基糖和核苷酸代谢、能量代谢和脂多糖(LPS)生物合成相关的微生物代谢功能显著增加。类似地,2型糖尿病患者表现出与细胞糖摄取、外源性降解、与胰岛素抵抗增加相关的支链氨基酸输出以及与胰岛素敏感性降低相关的硫酸盐减少相关的微生物途径的富集。
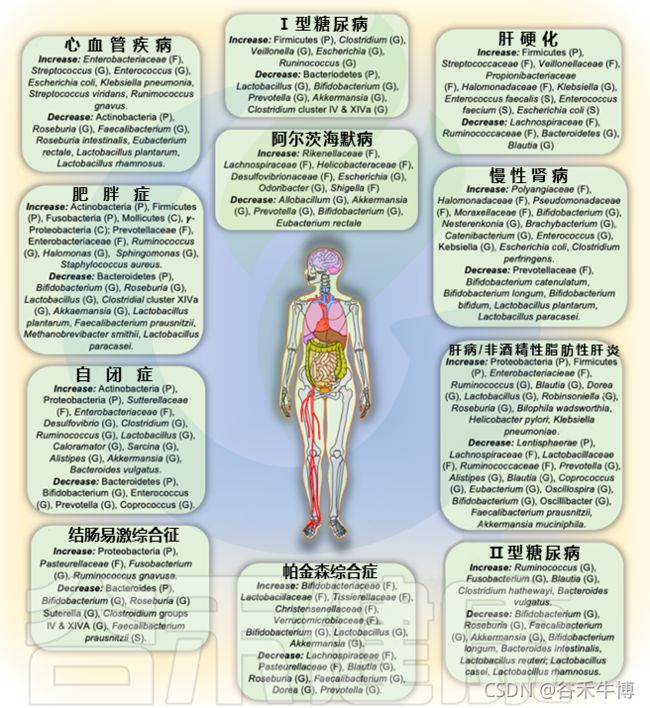
各类疾病中肠道菌群的变化
Dey P, et al., Free Radic Biol Med. 2021
抗生素引发肥胖
近年来,抗生素对“正常”肠道微生物群的破坏引起了人们的极大兴趣,因为它和肥胖表型有关。
来自美国人群观察数据表明,在抗生素使用率较高的州,肥胖的患病率增加。慢性代谢病患者普遍存在微生物分类多样性的下降,尤其是拟杆菌、普氏菌、脱硫弧菌、乳酸杆菌和草酸杆菌Oxalobacter。
在产前、产后、儿童期或成年早期使用抗生素可能会破坏肠道微生物群,降低微生物多样性,导致共生菌的长期耗竭,并可能与晚年的肥胖有关。
由于肠道微生物群的破坏,抗生素治疗的可能致肥胖效应也已在小鼠中得到验证:其中来自成年(18周)正常对照组和青霉素治疗小鼠的微生物群转移到年轻GF小鼠(3周)中。在幼崽出生前和断奶过程中,母鼠接受青霉素治疗后,肥胖和脂肪生成基因的肝脏表达增加,而断奶后接受青霉素治疗的小鼠体重与正常对照组相似。
此外,微生物群可将膳食磷脂酰胆碱、卵磷脂和l-肉碱转化为三甲胺(TMA),三甲胺最终在肝脏代谢形成TMAO,从而加速动脉粥样硬化。
粪菌移植 ——新的治疗模式
1958年的首次证明了肠道微生物群作为治疗剂的潜力,以限制伪膜性小肠结肠炎的感染,2013年,将健康捐赠者的粪便输注给艰难梭菌感染患者比万古霉素治疗更有效。粪便微生物群移植还可以通过提高免疫治疗的疗效而有益于癌症等遗传疾病,这为难治性疾病的治疗开辟了新的前沿。
然而也有失败案例,粪菌移植可能不是所有疾病的灵丹妙药,饮食干预和生活方式改变等策略可能是最佳健康的先决条件。
02 肠道代谢
肠道代谢物感应机制
新陈代谢通过从饮食中提取能量来驱动所有生物过程。在肠道中,微生物多样性代谢过程产生的代谢物会改变宿主特异性反应。
到目前为止,肠道代谢物感应机制主要归因于宿主G蛋白偶联受体(GPR),其在连接饮食微生物群-代谢物轴方面起着关键作用。例如,短链脂肪酸受体,如GPR41和GPR43;中长链脂肪酸受体GRP40和GRP120;在肠细胞和其他组织中表达的鹅去氧胆酸受体法尼类X受体(FXR)α参与调节多种宿主特异性代谢过程,如抑制胰岛素分泌,减少非酯化脂肪酸释放,抑制胆汁酸合成,调节胆固醇和三酰甘油合成。
芳香烃受体(AhR)是另一类代谢物传感器,通过整合环境、饮食和微生物信号来调节免疫代谢稳态。AhR的主要配体是色氨酸代谢物,然而,丁酸也可以作为AhR配体发挥作用。肠道缺乏AhR或缺乏AhR配体导致肠道微生物负荷和组成改变,增加粘膜炎症和屏障功能障碍,微生物群AhR相互串扰可调节宿主组织中的脂肪酸(FA)和葡萄糖代谢。
总之,最近的数据表明,肠内AhR依赖性信号的调节可以抑制甾醇调节元件结合蛋白-2的转录活性,从而限制了胃肠道胆固醇转运体1介导的胆固醇摄取nieman - pick C1-like 1 (NPC1L1)。
肠道激素
肠源性激素可对宿主代谢过程产生深远影响,包括肠外组织。例如,十二指肠I细胞分泌的肽激素胆囊收缩素家族可诱导胰酶分泌、胃肠道和胆囊收缩,并诱导胰腺胰岛素分泌。
GLP-1
肠促胰岛素类激素,如胃抑制多肽(GIP)和胰高血糖素样肽-1(GLP-1),影响代谢过程,如脂肪和肌肉葡萄糖摄取,通过有效的胃肠葡萄糖感应增加胰岛素生物合成和分泌,抑制胰高血糖素分泌,增加脂肪分解,脂肪酸合成,降低肝脏糖异生。总之,肠内分泌L细胞分泌的GLP-1起限制粘膜炎症和诱导粘蛋白分泌的肠道屏障保护作用。累积证据表明,肠道微生物群的营养调控可以给宿主带来代谢健康益处,影响GLP-1依赖性代谢过程。
INSL5
最后,由结肠L细胞产生的新发现的激素胰岛素样肽5(INSL5)在禁食和热量限制后上调。INSL5可以通过影响胰岛素分泌和胰腺β细胞内稳态来调节葡萄糖内稳态。最近的数据显示GF小鼠结肠INSL5表达降低,而微生物定植或高脂饮食(HFD)补充恢复INSL5水平,并且INSL5-KO小鼠改善了胰岛素耐受性并降低了肝脏葡萄糖生成。这些数据共同表明微生物对葡萄糖稳态的调节可能通过调节INSL5发生。
缺氧和氧依赖过程
肠道氧张力在调节和划分粘膜免疫代谢过程、稳定厌氧菌群和肠道能量收集过程中起着重要作用。
能量代谢改变影响粘膜组织动力学的证据来自肠内短链脂肪酸的生成,其改变上皮细胞的能量稳态。例如,在正常条件下,肠上皮细胞可以通过丙酮酸的氧化磷酸化利用乙酰辅酶A中的葡萄糖。然而,在管腔短链脂肪酸产量增加的情况下,结肠细胞可以优先将丁酸作为主要能源,使组蛋白脱乙酰化失活,从而通过增加丙酮酸脱氢酶激酶的表达抑制丙酮酸的氧化代谢。因此,在丁酸丁酯增加的情况下,氧化代谢所需的乙酰辅酶A来自丁酸的β-氧化。丁酸盐的这种优先摄取对于维持肠道免疫代谢稳态非常重要,因为丁酸盐水平的增加提高了缺氧诱导因子(HIF)的粘膜表达,HIF转录调节与肠道屏障保护相关的基因。
相反的数据表明,丁酸通过降低Caco-2和IEC-6细胞中缺氧反应元件的DNA结合能力来抑制HIF依赖性缺氧敏感基因的转录活性。尽管如此,缺氧诱导的HIF稳定对于肠道内环境稳定至关重要,因为其转录调节屏障保护基因、粘蛋白分泌、抗菌肽形成、核苷酸信号、铁代谢和代谢基因,如己糖激酶、乳酸脱氢酶、丙酮酸激酶、醛缩酶、磷酸果糖激酶、磷酸甘油酸激酶等。在管腔缺氧条件下,缺氧细胞需要满足其较高的细胞代谢能量需求。肠道高度增殖的干细胞、转运扩增祖细胞和有丝分裂后分化细胞不断进行高能消耗的再生、消化、分泌和吸收过程。
最近,PRDM16蛋白被确定为肠道脂肪酸氧化的关键转录调节因子,是转运扩增祖细胞存活和增殖的先决条件。在病态肥胖患者胃旁路手术期间收集的皮下脂肪中,PRDM16的表达仍然与肠道微生物群密切相关,表明PRDM16对宿主能量代谢和胰岛素敏感性的依赖性调节可能受到肠道细菌的影响。
氧化应激与胃肠道疾病
在婴儿期,兼性细菌(如肠杆菌科,肠球菌科,链球菌)的大量繁殖形成一个还原腔环境,到1岁时,支持厌氧共生菌(如双歧杆菌科,拟杆菌科,梭状芽胞杆菌)比需氧菌多100-1000倍的定植。
粘膜损伤
一般来说,具有氧化能力的活性物种的胃肠道生产过剩可能是由于外源性(如吸烟、饮食、酒精、药物)和内源性(如细胞呼吸、呼吸爆发、黄烷氧化酶、NADPH氧化酶、环氧合酶、过渡金属、一氧化氮合酶、髓过氧化物酶)引起的可导致脂质过氧化、DNA和细胞蛋白质氧化损伤、细胞内信号转导和基因表达模式改变,从而导致粘膜损伤。
肠粘膜的氧化应激加剧可通过细胞骨架蛋白、紧密连接蛋白和细胞内调节蛋白的巯基氧化、硝化、磷酸化和羰基化等机制导致紧密连接蛋白的丢失。在正常情况下,虽然厚厚的粘液层和抗菌肽阻止了肠上皮和肠腔微生物之间的直接相互作用,但体外和体内数据表明,肠道共生体在与上皮细胞接触时可快速触发自由基的产生。
粘膜的抗氧化防御
粘膜的抗氧化防御主要由谷胱甘肽相关酶控制,如谷胱甘肽还原酶、谷胱甘肽过氧化物酶、谷胱甘肽氧化还原酶和谷胱甘肽-S-转移酶。上皮中的谷胱甘肽含量为毫摩尔浓度,在粘液层的维持、吸收和解毒功能中起重要作用。粘液相关谷胱甘肽可以通过催化反应性亲电试剂、致癌物和药物的结合解毒来限制粘膜损伤。回肠的活性氧(ROS)水平取决于细菌负载量,可通过在涉及诱导型一氧化氮合酶和NADPH氧化酶1的过程中触发一氧化氮和超氧自由基的产生来防止细菌从远端肠道回流。不依赖于饮食的肠道微生物群可以调节肠道谷胱甘肽水平。
活性氧——细胞通讯方式的进化
与粘膜氧化应激的破坏作用相反,早期数据表明肠道共生细菌诱导的肠道活性氧生成可促进上皮修复,改善肠道屏障功能,并从右旋糖酐硫酸盐诱导的小鼠结肠炎中恢复。
控制补充鼠李糖乳杆菌GG可以通过激活Nrf2依赖的细胞保护和氧化还原稳态过程,减少对乙酰氨基酚和乙醇诱导的小鼠和果蝇肝脏氧化应激,口服补充产过氧化氢酶的乳酸乳球菌可以减轻1,2-二甲基肼诱导的小鼠结肠癌,在不同的乳酸杆菌菌株中也发现了特定的氧化应激抵抗基因(例如硫氧还蛋白还原酶、过氧化氢酶、谷胱甘肽还原酶、NADH脱氢酶)。然而,包括共生菌在内的小肠细菌过度生长可加重粘膜氧化损伤。
因此,维持氧化还原稳态对于有效的宿主微生物群串扰至关重要,因为活性氧很可能是一种细胞通讯方式的进化形式,氧化还原稳态的改变可能导致粘膜损伤。
肠能量代谢
肠道微生物群和肠道脂质代谢之间的相互对话的建立:HFD增加肠道微生物群能量收集能力以及GF小鼠对HFD诱导的肥胖具有抵抗力。
抗生素治疗的大鼠破坏了微生物群,表现出肠道脂质吸收降低,乳糜微粒的产生和黏膜载脂蛋白的减少。
肠道微生物因其在肠道脂质消化和吸收中的作用而对适应饮食脂质的变化至关重要。补充了HFD喂养的对应微生物群的GF小鼠,无论饮食脂肪含量如何,其肠道的脂质吸收率都有所提高。
脂质代谢
早期的研究表明,50%以上的粪便脂质来源于微生物,大部分是顺式/反式饱和和不饱和脂肪酸。肠道微生物具有磷脂酶C活性,从磷脂中生成甘油二酯。由于二酰基甘油可以作为细胞信使刺激蛋白激酶C,微生物二酰基甘油可以影响肠道信号转导和其他细胞过程。
脂肪酸代谢也可能与特定的肠道微生物代谢功能有关,如乳酸利用、丙酸代谢、琥珀酸形成和脱羧、硫酸盐还原、乙酸利用和丁酸合成。
某些微生物可以代谢脂肪酸,生成影响宿主代谢过程的独特代谢物。例如,乳酸杆菌、丁酸菌和巨球菌可以生成共轭亚油酸,这取决于亚油酸的异构体,可以不同程度地影响宿主的胰岛素敏感性。
关键调节因子
近年来,条件性基因敲除(KO)或过表达研究已经确定了几种肠道过程是宿主代谢的关键调节因子。如PRDM16、Mttp、schlafen 3、KHK、Ctr1等。
肠道代谢调节
一些肠道特异性代谢调节剂被提出作为治疗慢性病的靶点。例如,核受体过氧化物酶体增殖物激活受体γ(PPARγ)先前已知主要在脂肪组织中表达,并调节脂肪酸氧化、胆固醇代谢、能量消耗,在结肠上皮中也高表达。
通过饮食调节PPAR-γ信号,可以破坏小肠正常微生物和生理表型。补充PPAR-γ拮抗剂罗格列酮的小鼠,可显著降低回肠绒毛间区的微生物过度生长,减少抗菌肽分泌,并减轻补充HFD引起的肠道屏障功能障碍。
PPAR-γ在饮食脂质诱导的粘膜免疫反应中起重要作用。在代谢应激下,肠上皮的PPAR-γ通过增加交感神经系统的活动促进全身能量动员。具有肠肝亲和性的PPAR-α配体可能被用于治疗动脉粥样硬化性血脂异常。
另一类肠道代谢调节剂是属于G蛋白偶联受体超家族的内源性大麻素受体。内源性大麻素系统严格控制脂肪摄入,是治疗肥胖的潜在靶点。
神经递质的肠道生物合成
肠道微生物是小型代谢工厂,也与影响人类健康的各种代谢过程有关。例如,已经在肠道微生物中鉴定出几种与宿主相关的代谢物的生物合成能力。例如,大肠杆菌、屎肠球菌、唾液链球菌和短双歧杆菌可以产生神经递质,这些递质可能沿着肠-脑轴调节宿主的神经反应。
神经递质的代谢,如5-羟色胺、儿茶酚胺和γ-氨基丁酸(GABA)也受肠道微生物群的影响。由于对结肠细胞膜转运系统和肝脏代谢的影响,GF小鼠血浆和粪便中GABA浓度降低。喂食致肥胖饮食的万古霉素治疗小鼠粪便GABA较低,而甲硝唑可提高GABA。
此外,喂养生酮饮食会增加GABA水平,而使用含有氨苄西林、万古霉素、新霉素、甲硝唑的抗生素混合物治疗会降低GABA水平。
与GF小鼠相比,常规小鼠在循环和粪便中的5-羟色胺水平更高。这些研究表明,对肠道微生物群有不同影响的饮食或抗生素也会影响神经递质的生成,从而引起肠脑轴的变化。
肠道异源代谢
口服补充药物的代谢受到肠道酶的影响。特别是,细胞色素P450类酶负责几种临床相关药物和膳食植物化学物质的第一阶段代谢,这些药物和植物化学物质可以改变粘膜免疫平衡。编码NADPH-细胞色素P450还原酶的细胞色素P450还原酶(CPR)基因的肠上皮特异性敲除,导致硝苯地平和洛伐他汀的代谢显著降低,并增加循环中未代谢母体药物的生物利用度。CPR与肠道药物处置无关,而仅与代谢有关。
CYP3A是肠上皮的主要细胞色素,使用酮康唑选择性抑制CYP3A可提高不同免疫抑制剂的口服生物利用度。小鼠肠道CYP1A1的基础或诱导表达依赖于识别Toll样受体2的病原体。
在肠道慢性炎症条件下,CYP3A的表达可能受到抑制。炎症性结肠炎小鼠CYP3A和P-gp表达降低,在肠道药物代谢和转运中起重要作用。这些宿主特异性细胞色素P450依赖性药物代谢也可能受到宿主-微生物相互作用的影响。
在人类中,广谱抗生素克拉霉素的治疗抑制了肠道CYP3A4和CYP3A5的活性,而与蛋白质表达的变化无关。
03 代谢组
肠道代谢组是由各种肠道特定代谢过程产生的总代谢产物,由于这些代谢物和小代谢中间产物调节肠道免疫代谢稳态,并维持宿主和微生物之间的互利共生和致病性相互作用。
饮食来源或微生物来源的肠道代谢物影响宿主体内平衡、脂肪储存、糖代谢、免疫调节和内分泌功能。
Dey P, et al., Free Radic Biol Med. 2021
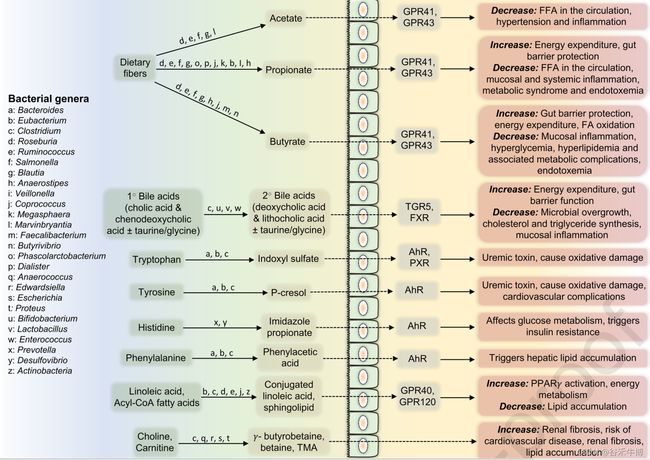
肠道产生的代谢物可以局部影响肠道屏障或粘膜免疫平衡,也可以通过主动或被动转运穿过上皮层影响肠外组织。其中一些代谢物包括短链脂肪酸、三甲胺N-氧化物(TMAO)、胆碱、丙酸咪唑、共轭亚油酸、次生胆汁酸、小酚类,这些代谢物由膳食成分产生,或其微生物合成受到膳食营养素和植物化学物的影响。某些代谢物的肠道形成或肠道代谢组的改变通常与慢性代谢疾病(如肥胖和II型糖尿病)有关。
短链脂肪酸
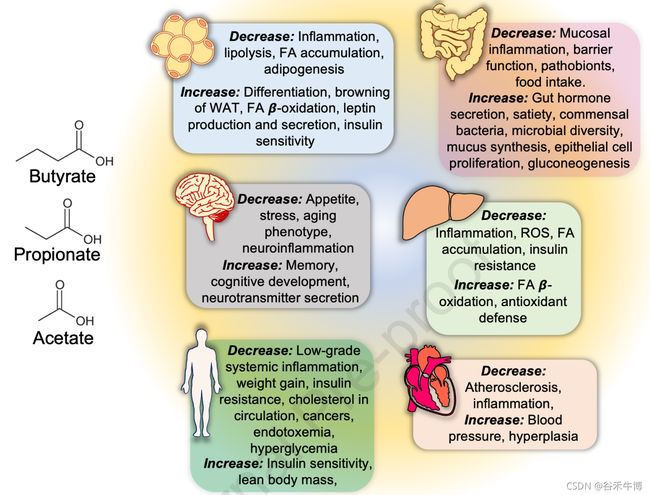
微生物代谢过程产生的各种代谢物可能占宿主每日能量需求的约10%。某些肠道细菌(例如, Faecalibacterium prausnitzii, Roseburia spp., Butyricicoccus pullicaecorum)通过膳食纤维、抗性淀粉和未消化蛋白质的厌氧发酵合成短链脂肪酸(丁酸、乙酸、丙酸)。这些短链脂肪酸可对宿主产生多种有益影响。
Dey P, et al., Free Radic Biol Med. 2021
短链脂肪酸,尤其是丁酸盐,是限制体重增加的原因,而植物化学物质对健康的有益作用可归因于改善肠道中的产丁酸菌或提高其短链脂肪酸代谢能力。
短链脂肪酸可通过GPCR发出信号,影响广泛的过程,如胰岛素和ghrelin的分泌、GLP-1、肽酪氨酸酪氨酸(PYY)、中性粒细胞迁移、炎症小体的形成和诱导促炎症环境。特别是在肠上皮,短链脂肪酸可以通过影响信号转导途径、树突状细胞和巨噬细胞激活、T细胞分化以及其他免疫活性细胞的趋化性和增殖来维持促炎和抗炎细胞因子的平衡,从而调节免疫稳态。
短链脂肪酸可以上调上皮HIF依赖性反应,从而转录上调屏障保护基因的表达,例如claudin (CLDN-1)、occludin (OCC)、zonula occludens (ZO)-1、mucin (MUC)-2和β- defenensins,从而限制细菌热原代谢物(如LPS)的肠道至全身易位。
蛋白质衍生代谢产物
在蛋白质衍生代谢物中,梭菌、丙酸杆菌、拟杆菌和链球菌可将大肠膳食蛋白质中的氨基酸从支链脂肪酸和多胺中降解,色氨酸代谢物是研究最充分的一组,据报道可促进3型先天性淋巴细胞中IL-22的产生,增强IL-10的产生,并改善屏障保护基因的表达。
吲哚硫酸酯和吲哚-3-丙酸由色氨酸生成。吲哚-3-丙酸通过孕烷X受体(PXR)和TLR4发出信号来加强肠道屏障,并通过缓解肠肝轴上的失调和内毒素移位来抑制NASH。硫酸吲哚氧基是一种尿毒症毒素,通过限制抗氧化反应和降低Nrf2依赖性细胞保护活性,对肠上皮细胞造成氧化损伤。
膳食代谢产物与肠道调节
由于胃肠道含有数以万亿计的细菌,决定肠粘膜的免疫耐受或免疫反应是维持3M相互作用的重要决定因素。除了特定的微生物群(即共生菌或致病菌)和肠道空间免疫表型决定胃肠道免疫稳态外,来自饮食或微生物的胃肠道代谢物也会影响胃肠道免疫反应。
来自膳食来源的代谢产物的胃肠道生成是由宿主酶机制和细菌代谢过程的联合作用完成的。
膳食成分及其肠道代谢产物如何通过肠道免疫调节过程在健康中发挥作用?
小肠单糖可被乳酸杆菌和链球菌降解为丙酮酸和乳酸,而毛螺菌科、瘤胃球菌和拟杆菌可将不易消化的纤维分解为短链脂肪酸和琥珀酸。
丙酮酸和乳酸可通过GRR31受体发出信号,诱导肠道CX3CR1巨噬细胞树突突起,从而增强局部免疫反应,并防止沙门氏菌感染。
短链脂肪酸表现出多种免疫调节活性:
a. 通过激活线粒体β-氧化和增加缺氧来影响免疫活性细胞的代谢,并促进B淋巴细胞增殖共同介导;
b. 抑制组蛋白去乙酰化酶,从而促进分泌抗菌肽的巨噬细胞分化,并促进幼稚CD4 T淋巴细胞分化为Th1或Th17细胞;
c. 激活诱导NLRP3炎症体的GPCR,抗原特异性Th2细胞产生免疫抑制IL-10,以及Th1和Th17细胞产生IL-22
双歧杆菌、链球菌、丙酸杆菌、寡养单胞菌(Stenotrophomonas)和乳酸菌可将小肠中的脂肪酸从共轭亚油酸、羟基脂肪酸、氧基脂肪酸中分解,和10-羟基顺式-12-十八碳烯酸共同调节多种免疫功能,如抑制炎症中性粒细胞募集、抑制促炎症环境、巨噬细胞介导的细胞碎片清除和组织重塑。
花生四烯酸由亚油酸生成,亚油酸是类二十碳烯酸的前体,如前列腺素、白三烯、血栓素和脂氧素。
前列腺素可通过抑制TNF的机制对肠道屏障产生不同的影响。TNF-α 来自巨噬细胞、来自树突状细胞的IL-12,IFN-γ来自自然杀伤细胞,同时刺激3型固有淋巴细胞分泌IL-22。
白三烯(LT)D4可与上皮半胱氨酸白三烯受体1相互作用,通过激活磷脂酶C/Ca2þ/蛋白激酶C信号引起肠道屏障破坏。
LTD4和LTB4处理肠道上皮细胞后,通过上调抗凋亡蛋白Bcl2,影响COX2、β-连环蛋白、PGE2的表达,提高细胞存活率。
脂毒素可通过与上皮细胞基底外侧表面的GPCR结合来抑制粘膜炎症反应,GPCR相对靠近富含免疫细胞的固有层,并诱导抗炎介质的表达。
04 定义3M相互作用的挑战
肠道,就像身体中的任何其他器官一样,受到饮食等环境因素的影响。数以万亿计的细菌在肠腔的定植及其相互作用影响肠道代谢,对整个宿主系统造成巨大的适应压力。
宿主-微生物相互作用
肠道-宿主-微生物群相互作用对肠道微生物群的影响如此复杂,以至于缺乏宿主特异性因素(例如,TLR4、干扰素诱导蛋白AIM2、防御素α5、MUC2、JAMA、载脂蛋白A-I、脂肪酸摄取受体CD36和乙醛脱氢酶1家族成员L1、AHR、维生素D受体)也可导致肠道微生物群的改变。因此,破译相互独立的宿主和微生物群依赖的肠道水平稳态机制仍然是一个巨大的挑战。
微生物与宿主之间的共生关系是由宿主对共生群落的免疫耐受所支持的,这种免疫耐受是在进化过程中形成的适应性选择过程。
然而,肠道对微生物群的选择性免疫耐受是令人困惑的,其过程大部分是未知的。有假设认为,胃肠道免疫系统可能包含通过B和T淋巴细胞来源的受体、表面结合抗体和识别受体的特定模式来识别细菌抗原的特殊细胞。
肠道中的一些受体,如PPAR、糖皮质激素受体、肝X受体、FXR、维生素D受体、RAR相关孤儿受体γ、肝细胞核因子4α、雌激素受体α,孕烷X受体可以微调肠道免疫反应,并对肠道代谢过程产生差异影响。
因此,适当的饮食和药理学策略,有效地调节这些肠道特异性信号可能有助于慢性代谢疾病的治疗。
肠道动态生物地理学
破解3M相互作用的另一个挑战是肠道的动态生物地理学。
管状肠就像多个功能和环境不同的器官缝合在一起形成一个单一的器官。而微生物丰度和多样性、内毒素浓度、粘蛋白、pH值、次级胆汁酸等因素向远端肠逐渐增加,O2张力、抗菌剂、营养素可用性、初级胆汁酸和氧化还原电位向近端肠逐渐升高。这些因素加上空间免疫表型决定肠道微生物定植,并促进沿肠道长度的不同区域特异性表型。
尽管数据表明微生物在肠道不同部位的不同定植,但它是否以区域特异性机制影响宿主的肠道过程仍不得而知。
微生物特异性活动
肠道微生物研究中,最大的挑战之一是破译哪种微生物在做什么?
尽管肠道微生物很可能不是独立运作,而是作为一个群落发挥作用,在这个群落中,定植依赖于代谢和领地生态位的建立,至少了解特定肠道微生物群在人类健康中的作用将有助于针对特定人群或使用特定微生物介导的策略来改善人类健康。
在肠道微生物研究中,数据报告的类型往往会产生误导。某一特定微生物(如长双歧杆菌)是更大群的一部分,属(双歧杆菌),科(双歧杆菌科),目(双歧杆菌科);纲(放线菌纲)或门(放线菌纲)水平。特定微生物在特定系统发育水平下的表征可能会得出不同的结果。例如,虽然长双歧杆菌具有抗肥胖作用,但肥胖个体中放线菌(Actinobacterium)的比例较高。
微小类群的变化如何影响整个微生物群,以及宿主系统如何受到影响,目前仍是相关研究的重点。具体的细菌是如何对健康有益的影响或疾病发病机制需要确定。
肠道菌群的体外培养
从肠道中获取可存活和可培养的细菌是一个巨大的挑战。但体外培养是实验理解特定细菌的生物学作用和利用它们作为治疗手段的先决条件。
与好氧和兼性厌氧菌相比,低氧肠道中厌氧菌的数量是它们的3-4倍,因此分离和纯化可存活的厌氧菌并进行成功的培养是一个极端的挑战。
例如,Akkermansia被认为是一种肠道共生。然而,由于其专性厌氧性质,从结肠中分离Akkermansia和成功培养仍然具有挑战性。
外源性微生物代谢和生物利用度
新药物发现中的一个棘手方面是肠道微生物代谢能力,其生物转化外源性物质并有助于潜在药物的生物利用度和药代动力学。
除此之外,还有肠道区域特异性药物代谢,第一阶段和第二阶段代谢分别发生在回肠和结肠,它们由不同的微生物群主导。
虽然包括生物活性植物化学物质在内的许多新兴药物在使用微生物独立的体外技术测试时显示出很有前景的效果,但在临床环境下测试时,由于母体药物明显的微生物分解,它们可能不那么有益。三种著名的天然产物,即姜黄素、槲皮素和表没食子儿茶素没食子酸酯,都经过了生物转化,但肠道微生物群及其肠外组织水平的益处可能是由于微生物代谢物,而不是母体化合物。
肠道内其他微生物
肠道健康的另一个未被充分研究的方面是肠道微生物与宿主之间的跨界相互作用。
肠道病毒群
比如说,在这次疫情中,肠道微生物群可能与严重的COVID-19感染有关,与健康对照组相比,COVID患者的条件致病菌比例明显更高,有益共生菌比例更低。这些关联显然可能是表面的,但在肠道水平上可能对宿主产生深远的影响。
肠道真菌群
除了细菌,肠道里还居住着真菌、古菌、原生生物和病毒。肠道病毒群与人类健康和疾病有关。据估计,每克人体肠道中含有108 - 109个病毒颗粒,数量比细菌多20倍。直到最近,可靠且可重复的肠吞噬体宏基因组研究方案才被开发出来。由于噬菌体可以感染细菌,破译肠道病毒群是如何直接通过与粘膜免疫系统相互作用或影响细菌群来调节宿主健康将是一件有趣的事情。
肠道真菌群具有多种独立于宿主的代谢能力,并表明真菌代谢产物与细菌代谢产物相似,可以调节肠道免疫代谢过程,但细菌和真菌群落之间的相互作用在很大程度上仍是未知和被忽视的。
界间相互作用探索
用于研究这些界间相互作用及其对肠道组织的后续影响的体外共培养技术在很大程度上还处于初级阶段,因此,界间相互作用如何影响人类健康和疾病的基本理解仍有待探索。
超越母体膳食植物化学物质的肠外生物活性
被称为植物化学物质的特定植物源微量营养素已经成为一种很有前景的治疗和/或预防策略。
新的数据表明,植物化学物质在肠外组织的生物活性在生物活性的程度、植物化学物质的代谢和生物利用度的改善方面最可能由肠道微生物群决定。
一个典型的例子是大豆黄酮,它由Slackia、Lactococcus、Adlercreutzia、Eggerthela代谢生成具有优于母体大豆苷元的抗氧化和雌激素特性的雌马酚。
链球菌和乳酸菌在肠道内代谢产生的代谢产物鸢尾苷和鸢尾酮比其亲本植物化合物鸢尾苷和葛花苷具有更好的雌激素作用。
此外,与前体鞣花酸和鞣花单宁相比,苯并香豆素类化合物尿石具有更好的肠道吸收、更高的生物利用度和更高的生物活性,是由肠道微生物活性形成的。
这些初步证据表明,亲本植物化学物质在肠道产生的微生物代谢物明显与口服植物化学物质的肠外生物活性有关。事实上,肠道微生物如何影响植物化学物质的生物利用度的证据进一步支持了这些假设。
一般来说,除了少数(如萝卜硫素)外,大多数口服植物化学物质由于肠道吸收、微生物降解和宿主I期和II期代谢不良而生物利用度低。
植物化学物质微生物代谢
微生物对植物化学生物利用度和生物活性的影响已被许多报道。黄酮类苷黄芩苷是植物化学物质微生物代谢的一个有趣的例子。补充常规小鼠对黄芩苷的吸收结果只有在肠道微生物水解其苷元形成黄芩苷后,再与黄芩苷重新接合。然而,添加黄芩苷的GF小鼠的生物利用度显著降低。
肠道微生物在提高生物利用度中发挥作用
肠道微生物在提高植物化学生物利用度方面的类似作用在生物碱小檗碱的情况下也很明显,小檗碱水溶性低,肠道吸收差。粪肠球菌和阴沟肠杆菌( Enterobacter cloacae)通过将小檗碱还原为二氢小檗碱促进肠道吸收,二氢小檗碱在吸收后氧化还原为小檗碱。
植物化学毒性中发挥作用
除了提高生物利用度和提高生物活性外,肠道微生物可能在植物化学毒性中发挥重要作用。例如,厌氧菌属于细菌门,它含有β-葡萄糖苷酶,通过催化苦杏仁苷转化为氰化物而产生毒性。然而,当GF小鼠口服补充苦杏仁苷或常规小鼠肠外给予苦杏仁苷时,均未观察到毒性,这证实了苦杏仁苷诱导的氰化物毒性中肠道微生物的核心作用。
05 结 语
饮食是调节3M相互作用的最重要的环境因素。饮食、消化和吸收的胃肠道转变可以作为有利于调节3M内环境平衡的重要工具。
我们对饮食和人类健康的基本了解大多来自动物实验和细胞系研究,而关于疾病发病机制的饮食质量和数量的临床研究和基于人群或流行病学的数据仍然严重缺乏。创新的交付策略如纳米载体可用于生物活性植物化学物质的靶向递送和控释,这也将提高系统生物利用度。
由于与减少全身炎症和改善肠道微生物群有关,发酵食品和共生策略正在成为维持肠道免疫代谢稳态的明智策略。
此外,与肠道代谢组一致,肠道微生物检测有望以非侵入性方式揭示可预测的疾病风险识别标记,从而允许个性化营养和适合个人的定制治疗。
缺乏对3M相互作用的详细基础了解是发展以肠道为中心的预防和/或治疗策略的障碍。由于肠道以特定区域的方式被不同的微生物群落定植,以时空的方式定义宿主-微生物相互作用将本质上定义3M相互作用的真实性质。
此外,由于共生益生菌的过度生长也可能对宿主有害,一个待解决的问题是,什么是有助于维持肠道免疫代谢稳态的关键菌群?到底有没有什么“好”或“坏”的细菌,或者说是一种决定整体健康的群体效应?
对3M相互作用的基本理解有望通过未来的转化研究促进以微生物群为中心的预防和治疗策略的发展。
主要参考文献:
Dey P, Chaudhuri SR, Efferth T, Pal S. The intestinal 3M (microbiota, metabolism, metabolome) Zeitgeist - from fundamentals to future challenges. Free Radic Biol Med. 2021 Oct 2:S0891-5849(21)00746-2.
M.G. Dominguez-Bello, F. Godoy-Vitorino, R. Knight, M.J. Blaser, Role of the microbiome in human development, Gut 68(6) (2019) 1108-1114.
A. Salosensaari, V. Laitinen, A.S. Havulinna, G. Meric, S. Cheng, M. Perola, L. Valsta, G. Alfthan, M.Inouye, J.D. Watrous, Taxonomic signatures of cause-specific mortality risk in human gut microbiome, Nat.Commune. 12(1) (2021) 1-8.
S.-H. Lee, S.-H. Yoon, Y. Jung, N. Kim, U. Min, J. Chun, I. Choi, Emotional well-being and gut microbiome profiles by enterotype, Sci. Rep. 10(1) (2020) 1-9.
G. Li, W. Li, B. Song, C. Wang, Q. Shen, B. Li, D. Tang, C. Xu, H. Geng, Y. Gao, G. Wang, H. Wu, Z. Zhang, X. Xu, P. Zhou, Z. Wei, X. He, Y. Cao, Differences in the Gut Microbiome of Women With and Without Hypoactive Sexual Desire Disorder: Case Control Study, J. Med. Internet. Res. 23(2) (2021)e25342-e25342.
S.L. Prescott, History of medicine: Origin of the term microbiome and why it matters, Hum. Microbiome.J. 4 (2017) 24-25.
P. Dey, Gut microbiota in phytopharmacology: A comprehensive overview of concepts, reciprocal interactions, biotransformations and mode of actions, Pharmacol. Res. 147 (2019) 104367.
A. Zaborin, B.P. Bernabe, R. Keskey, N. Sangwan, S. Hyoju, N. Gottel, J.A. Gilbert, O. Zaborina, J.C. Alverdy, Spatial Compartmentalization of the Microbiome between the Lumen and Crypts Is Lost in the Murine Cecum following the Process of Surgery, Including Overnight Fasting and Exposure to Antibiotics, Msystems 5(3) (2020).