Cancer-secreted miR-105 destroys vascular endothelial barriers to promote metastasis,if=27.407 Cancer Cell. 2014 Apr 14;25(4):501-15. doi: 10.1016/j.ccr.2014.03.00
背景
microRNA可以被肿瘤细胞以外泌体的形式分泌出来,可以与周边的细胞进行crosstalk,进而起到远程调控的作用。可进行crosstalk的周边细胞种类包括:肿瘤微环境中纤维细胞、血管内皮细胞、同类肿瘤细胞等等。本文题目来看,是肿瘤分泌mir-105,作用于远处血管内皮细胞,调节血管内皮细胞屏障功能,而血管内皮屏障作用是肿瘤转移的一个步骤。两个基本内容mir105调节靶基因和肿瘤转移都是很基础的概念,为何能发表于cancer cell这种27分的杂志上呢?
我的研究方法
首先利用研究exosome的方法,证实肿瘤细胞可以分泌exosome,利用检测方法检测exosome内mir-105表达量增高。exosome的研究方法包括:提取分离的方法、电镜观察法、exosome表面特定标志物western检测;microRNA的pcr检测方法。然后验证外泌体内miR-105的生物学功能,需要将肿瘤细胞与血管内皮细胞共培养,观察血管内皮细胞的连接方式变化;制作乳腺癌动物模型,观察肿瘤转移数目和取血管内皮细胞观察连接方式改变;检测乳腺癌患者血清内miR-105表达水平,观察转移评价指标(DFS)。最后对miR-105调节的靶基因进行验证,靶基因通过网站筛选、双荧光素酶实验验证,验证的靶基因具有调节血管内皮细胞连接方式的生物学功能;可以行靶基因的rescue实验,证实miR-105调节的充要条件。
转移性肿瘤细胞分泌的exosome可以内皮细胞的转移
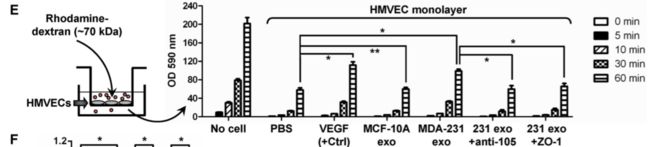
首先观察转移性肿瘤细胞和非转移性肿瘤细胞分泌的exosome功能学差异。转移性乳腺癌细胞 MDA-MB-231、乳腺上皮细胞MCF-10A。超速离心法分离exosome,电镜下观察。因为主要证明其与血管内皮细胞的关系,所以通过荧光染色验证人类微血管内皮细胞(HMVECs)可以摄取肿瘤细胞分泌的exosome。荧光电镜和流式细胞仪两种方法检测证实。transwell检测接受exosome后的HMVECs迁移功能的变化。结果显示:转移性乳腺癌细胞MDA-MB-231分泌的exosome,可以被HMVECs摄取,进而影响内皮细胞的迁移功能。那么exosome中哪种成分才是调节迁移的主要分子呢?
mir-105是转移瘤细胞分泌exosome中的调节迁移的分子
通过Solexa深度测序的方法检测转移性exosome和非转移性exosome中microRNA的表达差异,发现基本相同,也列表显示出差异microRNA表。但是最终还是选择了mir-105,而且据说还靶向TJP1:tight junction protein 1紧密连接蛋白(OZ1)。没有交代选择miR-105的标准,一般选差异最明显,作者只是说:we further focused on mir-105。之后选取数十种乳腺癌细胞系,有的是原发肿瘤细胞系,有的是乳腺癌胸腔积液分离出来的转移性细胞系。分别检测的原发瘤细胞和转移细胞系细胞内和exosome中miR-105的表达水平,发现不论是细胞内还是exosome中,在转移性细胞系中miR-105都高表达,提示miR-105是乳腺癌转移特异相关。
进一步验证转移性乳腺癌细胞MDA-MB-231分泌的exosome可以将miR-105转入内皮细胞。分别将MDA-MB-231和MCF-10A分泌的exosome与HMVECs共培养,分别利用PKH67和Cy3标记exosome和miR-105,荧光显微镜下观察不同染色的定位情况。最终证实MDA-MB-231分泌的exosome中miR-105可以转移至HMVECs中,而不是exosome刺激HMVECs产生大量miR-105.
前期的exosome分泌、转移内容证实之后,下面就对miR-105影响内皮细胞的功能进行深入研究,或者说miR-105调节的靶基因和生物学功能深入研究。我会先做一些生物学功能实验:干扰内皮细胞miR-105表达水平,观察迁移侵袭的变化;如果HMVECs培养能形成微血管,甚至可以观察微血管内皮细胞间距的变化。然后荧光素酶验证靶基因。
miR-105可以下调内皮细胞TJP1,破坏内皮细胞形成的屏障
首先双荧光素酶实验,验证miR-105可以靶向抑制TJP1基因,之后再在内皮细胞水平,转染miR-105之后,观察内皮细胞OZ-1 mRNA和蛋白的表达抑制。该实验干预内皮细胞内mir -105表达方法,不是使用siRNA或者miR-up等合成化合物,而是直接使用MDA-MB-231分泌的exosome,以及其他各种对照(MCF-10A),还涉及了rescue实验。总之证实了miR-105可以靶向抑制内皮细胞ZO-1蛋白的表达。以下内容为更专业的研究内皮细胞连接的方法。
1、培养基中内皮细胞连接成片,细胞间有细胞连接体。通过免疫染色ZO-1、OOccludin和E-caderin等细胞连接体,后免疫荧光电镜观察这些连接体的表达变化情况。
2、HMVECs细胞间通透性检测,permeablity assay:了解内皮屏障变化的直接效果,利用transwell小室,内皮细胞培养形成平铺一层内皮细胞膜,上层加罗丹明染料颗粒,后可以利用exosome调节内皮细胞的连接松紧程度,观察转入下层的罗丹明颗粒数量。甚至可以测量内皮细胞通透性阻抗electrical Resistance。除了观察罗丹明,还可以GFP标记MDA-MB-231癌细胞,观察癌细胞迁移数目的变化。
3、3D vascular sprout assay,3D培养内皮细胞,形成微血管树,然后给予exosome后,观察测量微血管树的变化,评估exosome对微血管的影响。
除了阐述miR-105的上述生物学功能,更重要的是证实ZO-1是介导miR-105生物学功能的充要条件,需要设计rescue实验,证明恢复ZO-1后,可以逆转miR-105的生物学功能改变。这部分内容不需要单独列出,在阐述mi-105的功能学变化过程中,多加入一组rescue组别即可,因为最终检测的biomarker都是一样的。
以下内容为动物模型水平,验证miR-105的生物学功能。
在动物模型水平,miR-105诱导血管通透性、促进肿瘤转移
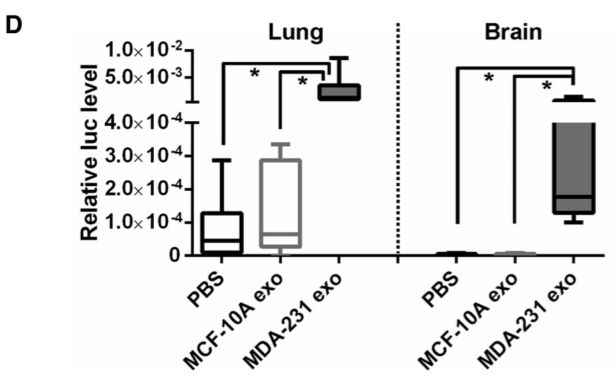
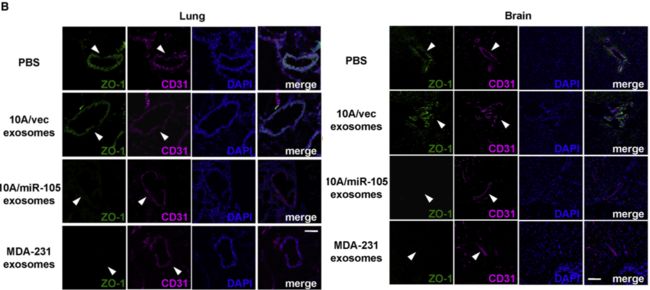
动物选取NOD/SCID/IL2Rγ null mice,用miR-105含量不同的exosome注射尾静脉处理干预,(exosome from MCF10A/vec (low-miR-105), MCF-10A/miR-105 (high-miR-105), or MDA-MB-231 cells (high-miR-105), or PBS as control)。 动物模型如何评估血管通透性和肿瘤转移性。
动物模型静脉注射染料罗丹明,观察肿瘤常见转移器官肺和脑组织中罗丹明渗透情况,如果肺或脑组织中罗丹明染料增多,提示血管通透性增加。
动物模型,评估肿瘤转移性,最常见的指标是转移瘤数目或大小。而本文则将移植瘤细胞首先利用荧光标记,然后在心内注射形成移植瘤,3周之后,提取肺和脑组织中荧光基因的表达量,表达量越高提示转移瘤负荷越大。
当然,肝肺组织病理切片,含量不同miR-105处理干预之后,免疫荧光染色观察OZ-1及occludin等细胞连接蛋白表达情况也可间接说明问题。(CD31染色提示血管结构,观察血管结构内OZ-1连接蛋白表达降低)。
动物模型,提高低转移性乳腺癌细胞中miR-105,可以促进肿瘤的转移
之前都是利用mir-105含量不同的exosome做干预,观察血管通透性和转移瘤负荷。那么原发瘤中miR-105高表达后,是否能起到同样的作用呢?首先制作高表达miR-105的移植瘤模型,选取 an MCF-10A-derived tumorigenic line, MCFDCIS, which forms lesions similar to comedo ductal carcinoma in situ that spontaneously progress to invasive tumors为细胞模型,检测细胞miR-105表达含量、细胞内ZO-1表达水平,以及细胞的迁移和转移属性,证实模型成功。之后同上一部分,检测罗丹明染料评估血管通透性、检测荧光基因评估转移瘤负荷,以及病理切片ZO-1染色。结果证实原发瘤高表达miR-105,同样可以抑制肺脑组织ZO-1表达、增加血管内皮通透性、促进肿瘤转移。
动物模型,抑制miR-105表达,可以抑制转移,恢复血管内皮通透性(rescue实验)
为了证实,miR-105抑制剂能否逆转上述生物学功能变化,具有治疗意义。动物模型制备同上一部分,干预处理措施为:尾静脉注射anti-mir-105,检测指标同上。结果显示anti--miR-105具有治疗意义。
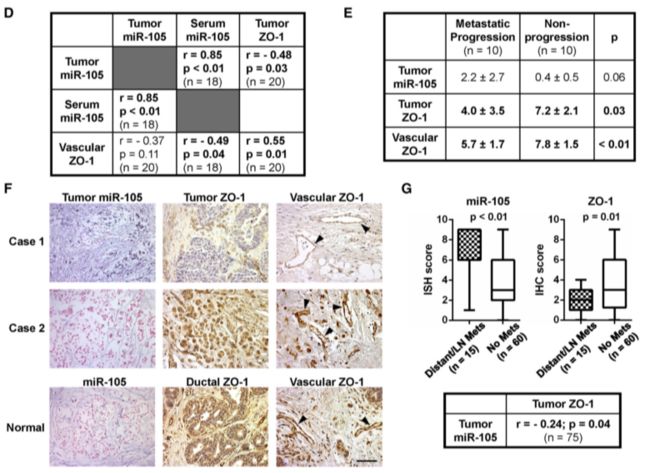
最后真实病例数据提供支持:乳腺癌患者miR-105表达水平与ZO-1表达和转移预后相关
检测瘤组织和血清mir-105表达水平,是否具有一致性,以及miR-105与ZO-1具有负相关,回顾性分析转移瘤和未转移瘤患者血清miR-105表达水平,高表达者发生转移率更高。或者生存分析预后。
总结
microRNA研究套路:细胞生物学功能、靶基因验证及介导功能的必要性、动物模型试验,最后在临床病例寻找证据,支持机制研究结论。这是基础研究的逻辑方式,首先在分子机制研究透彻了,然后找临床数据支持。而临床研究逻辑则相反:首先发现有临床现象和临床数据支持,然后在深入探讨细胞和动物水平有没有该现象,如果有的话,最后深入探讨分子基因互作机制。另外研究血管通透性相关转移,可以参考该文的实验方法。•
参考资料:
NOD/SCID/IL2γ null mouse:
NOD(non-obese diabetes)遗传背景:自发I型糖尿病;其巨噬细胞对人源细胞吞噬作用弱;先天免疫系统,如补体系统和树突状细胞功能降低。
• Prkdcscid :Prkdc(protein kinase DNA-activated catalytic)基因突变,小鼠的功能性T和B细胞缺失 ,淋巴细胞减少,表现为细胞免疫和体液免疫的重度联合免疫缺陷(severe combined immune deficiency, scid)。
• Il2rgnull: Interleukin-2受体的gamma链(IL-2R γc,又称CD132)位于小鼠X染色体上,是具有重要免疫功能的细胞因子Il2、Il-4、Il-7、Il-9、Il-15和I-21的共同受体亚基,该基因敲除后的小鼠机体免疫功能严重降低,尤其是NK细胞的活性几乎丧失。
B-NSG小鼠:综合了NOD-SCID-IL2rg背景特征,具有重度免疫缺陷表型,无成熟T细胞、B细胞和功能性NK细胞,细胞因子信号传递能力缺失等。非常适合人造血干细胞及外周血单核细胞的移植和生长。
优点
• 迄今世界上免疫缺陷程度最高的工具小鼠;
• 与NOD-scid小鼠相比寿命更长,平均长达1.5年;
• 对人源细胞和组织几乎没有排斥反应;
• 少量细胞即可成瘤,依赖于细胞系或细胞类型;