细胞转染对初接触细胞实验的科研人员而言,是一道难过的坎儿,细胞转染率低的话,你珍贵的细胞可能就只能扔掉了。
大家都知道,细胞是由带负电荷的磷脂双分子层构成,这对大分子物质来说是个不可透过的屏障,比如DNA和RNA的磷酸骨架,为了使核酸穿过细胞膜,开发了多种技术,大致可分为物理介导、化学介导和生物介导。
几种常见的转染方法:
1、脂质体转染法
阳离子脂质体表面带正电荷,能与核酸的磷酸根通过静电作用,将DNA分子包裹入内,形成DNA脂复合物,也能被表面带负电的细胞膜吸附,再通过融合或细胞内吞进入细胞。脂质体转染适用于把DNA转染入悬浮或贴壁培养细胞中,是目前实验室最方便的转染方法之一,其转染率较高,优于磷酸钙法。
2、磷酸钙共沉淀法
该方法可重复性差,而且磷酸钙溶液对温度、pH和缓冲盐浓度的变化十分敏感,对细胞尤其是原代细胞毒性较大,也不能采用RPMI培养基,因为其含有高浓度的磷酸盐。
3、电穿孔转染法
电流能够可逆地击穿细胞膜形成瞬时的小孔促使DNA分子进入胞内,这种方法就是电穿孔。
当遇到某些脂质体转染效率很低或几乎无法转入时可以用电穿孔法转染。
一般情况下,高电场强度会杀死50%-70% 的细胞。现在针对细胞死亡开发出了一种电转保护剂,可以大大的降低细胞的死亡率,同时提高电穿孔转染效率。
4、病毒感染
对于脂质体转染与电穿孔转染都无法成功转染的细胞系可以采用病毒感染,腺病毒,腺相关病毒,逆转录病毒和慢病毒载体已广泛用于哺乳动物细胞体内外的基因转染,转染效率比较高,适用于较难转染的细胞。
但是插入的片段长度有一定限制,最重要的是技术难度比较高,在一般实验室中很难普及,而且某些病毒起效时间比较慢,跟不上细胞这种快速繁殖的速度,如果只是做简单细胞系的转染性价比不高。
没有一种方法适用于所有的细胞和实验,理想的方法应根据细胞类型和实验需要进行选择,如果只是在细胞水平做,而且用的是简单细胞系,那么脂质体转染是综合比较起来不错的一个方法。
所以,我们主要来探讨一下脂质体转染:
进行实验之前,请先规划好你的实验,一般细胞转染需要24h-72h,所以要充分了解细胞生长速度,计算所需脂质体和DNA的储备量,并确认有足够的下列材料:Opti-MEM无血清培养基,Lipofectamine转染试剂,以及DNA,这个一定要确认好,否则生气都没办法怪别人。
做好以上准备后,具体的操作步骤如下:
1、细胞铺板
(1)一般会选择复苏细胞传代3-4次(汇合率达到90%之前对细胞进行传代,不要长到100%),从解冻过程中恢复过来可以稳定生长的细胞进行细胞转染,传代次数高(>30-40)时,细胞的生长速度和形态会改变。
(2)如果提总蛋白,一般选择六孔板进行转染,因为转染的细胞提取蛋白的总量能达到200ug,一般够做并且需要的DNA和Lipofectamine又相对比较少。
(3)传代条件取决于所用的细胞系。对于快速生长的细胞,倍增时间为16小时(如HEK293)。对于生长缓慢的细胞,倍增时间为36小时(如原代细胞)。
(4)转染当天,将细胞铺板。如果在转染前一天或更早时间铺板,转染效率可能下降,如果是简单细胞系的转染,可以直接在前一天晚上铺板,第二天来转染。转染时,细胞密度会影响转染效率,细胞密度保持在汇合率为70-90%(这个前提是转染24h,如果转染48h则需要汇合率为50-70%),细胞的铺板和转染也可同时进行。
2、细胞转染
吸去培养皿中的培养基,用PBS或者无血清培养基清洗一次。更换无血清培养基。准备转染制备液,用灭菌后的EP管制备。
以六孔板为例,A液:用200μl Opti-MEM稀释4μg质粒;B液:用200μl Opti-MEM稀释10μl lipo2000,分别将A液、B液轻轻混匀,静置5min,吸取B液加入至A液中,轻轻混匀,室温静置20min。
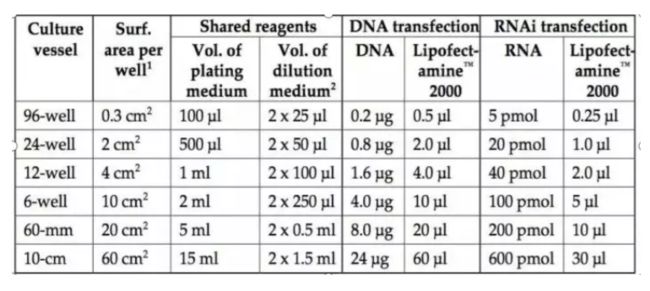
加入转染试剂到每个孔的培养基中,6h后,更换成完全培养基,继续培养到24-48小时(不同的质粒和脂质体最佳搭配比例不同,转染前,应该摸一个最佳配比。质粒:脂质体=1:1,1:1.5,1:2,1:2.5,1:3,1:3.5的梯度比例来检测最佳转染比例,一般质粒有带荧光,可以通过观察每组荧光强弱来判断转染效率)。以下为不同规格的培养板需要加DNA和lipo2000的量。
转染时,应使用优质质粒:
1、通过测量OD 值来确定DNA纯度和浓度,测得的OD值应介于1.7-1.9之间。脂质体转染基于电荷吸引原理,如果DNA不纯,如带少量的盐离子,蛋白,代谢物污染都会显著影响转染复合物的有效形成及转染的进行。
2、含有内毒素的质粒对细胞有很大的毒性作用。
转染时,小心轻柔的将lipo2000加到培养基中并轻轻混匀,避免粗暴用力吹打,会导致脂质体失效。
血清一度曾被认为会降低转染效率,老一代的转染方法往往要求转染前后用PBS洗细胞然后在无血清培养基条件下转染,但有些对此敏感的细胞会受到损伤,甚至死亡(比如贴壁较差的细胞,在PBS洗涤时很容易冲刷细胞)导致转染效率极低。
不过转染产品配方几经革新后的今天,对于主流的转染试剂来说,血清的存在已经不会影响转染效率,甚至还有助于提高转染效率,但是血清的存在会影响DNA-转染复合物的形成,在DNA-转染复合物形成时需用无血清培养基opti-MEM来稀释DNA和转染试剂,在转染过程中是可以使用血清的。
转染后6小时更换培养基,因为lipo2000具有一定毒性。
细胞培养过程中往往会添加抗生素来预防污染,但是抗生素可能对转染造成困扰。比如青霉素和链霉素,青链霉素是我们常用来预防污染的抗生素,就会影响转染,虽然这些抗生素一般情况下对于真核细胞无毒,但当转染试剂增加了细胞的通透性时,就会使抗生素也进入细胞从而间接导致细胞死亡,造成转染效率低。
目前转染试剂有些已经可以全程都用有血清和抗生素的完全培养基来操作,非常方便,省去了污染等麻烦。
3、观察转染的效果
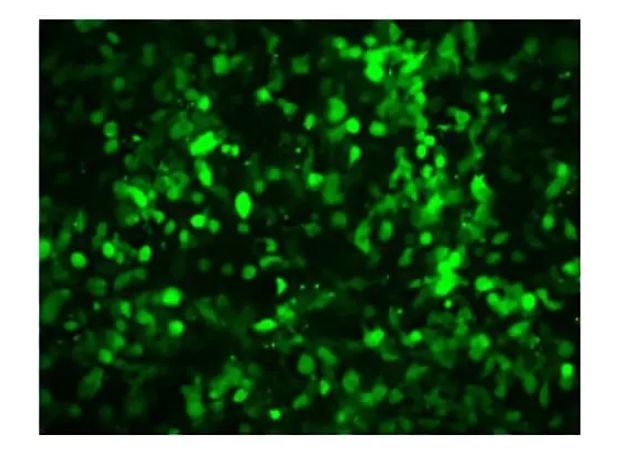
在转染后24小时,用荧光显微镜观察实验结果并记录荧光蛋白表达情况,如下图所示,说明转染成功,且转染效率还可以,如果不带有荧光,可以用GFP来对照,可以放在一个单独的孔中,或是与目标质粒共转染,同时用Q-PCR和者WB来检测。
转染后发现转染效率不高,可以通过两种方法:
1、复转染,即转染后12-24小时再次进行转染,前提是该细胞对脂质体的耐受性较好,转染后细胞死亡数较少。
2、通过药筛来杀死未转入成功的细胞。前提是该质粒带有抗生素抗性的基因。
你还没学会,没关系,学霸姐姐推荐——普诺赛(Procell)
Procell生物可以为你的细胞培养提供全程的帮助,产品丰富多样就不说了,以上各个环节所需要的细胞系、完全培养基、无血清培养基、基础培养基、血清、转染试剂、胰酶等等产品都有!学霸姐姐自己所在的实验室验证过了,非常可靠优质!
同时,这家还有很多生物实验技术方面的服务,强大的技术实力+丰富的经验,可以让你的细胞实验,全程无忧。
好了,学霸姐姐只能帮你到这里了,剩下的,只能靠你自己了!
生物女学霸,一个自称学霸其实很渣的生物汪,
努力将有趣的、有用的、有血有肉的科研那些事儿呈现给大家,
关注一个好不啦~