今天跟大家分享的是19年十二月份发表在Aging (Albany NY). (IF: 5.515)杂志的一篇文章,这是卵巢癌中假基因/lncRNA-miRNA-mRNA调控轴的研究,类似于ceRNA研究套路。
Dysregulation of pseudogene/lncRNA-hsa-miR-363-3p-SPOCK2 pathway fuels stage progression of ovarian cancer
假基因/lncRNA-hsa-miR-363-3p-SPOCK2调控轴失调促进卵巢癌的分期进展
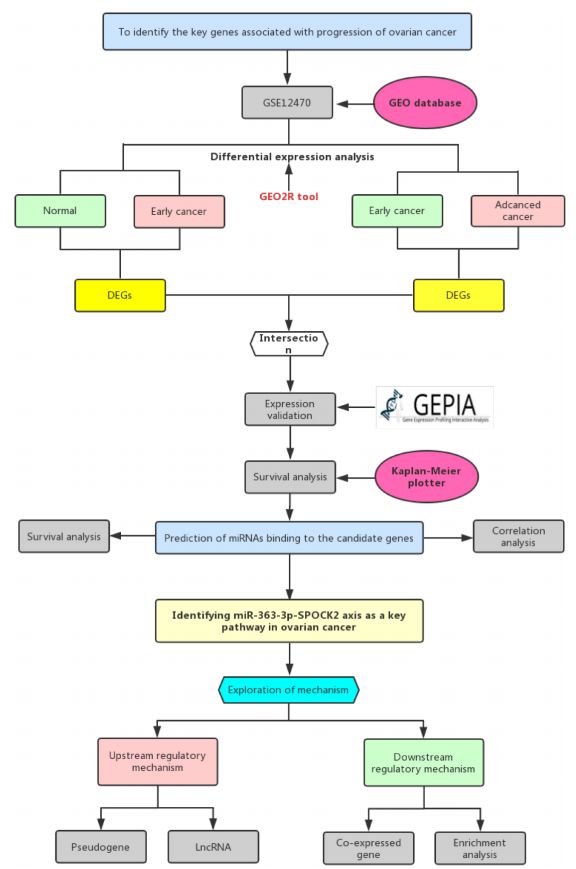
卵巢癌是女性中最常见的癌症类型之一。但卵巢癌进展的分子机制仍不清楚。本工作首先发现三个基因GJB2,S100A2和SPOCK2的表达水平在晚期显著高于卵巢癌的早期,且基因上调的卵巢癌患者的预后较差。经过靶miRNA预测,发现8、6和20个miRNA分别靶向GJB2,S100A2和SPOCK2。功能分析发现hsa-miR-363-3p-SPOCK2调控轴参与了肌动蛋白细胞骨架的调控。此外,发现6个假基因和8个lncRNA可能抑制卵巢癌中的hsa-miR-363-3p-SPOCK2调控轴。发现假基因/lncRNA-hsa-miR-363-3p-SPOCK2调控轴在卵巢癌进展中发挥重要作用,这可能为卵巢癌治疗提供有效的方法并作为潜在的预后标志物,工作流程图如图1所示。
图1 工作流程图
结果
1. 卵巢癌分期进展相关的候选基因筛选
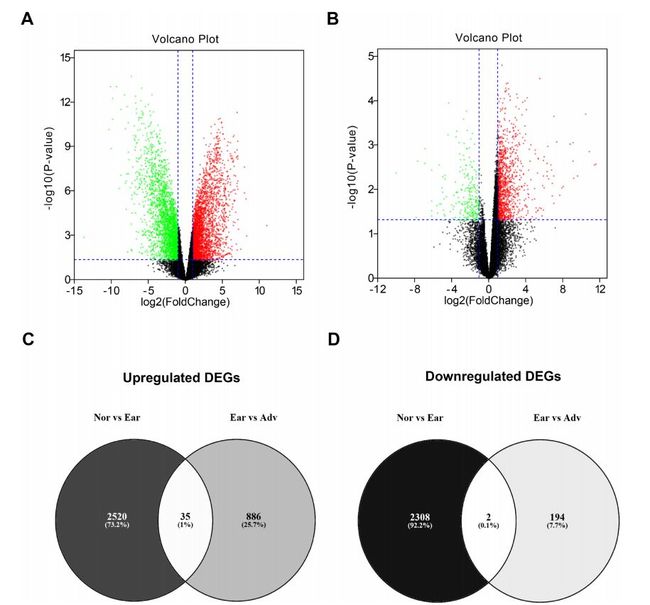
利用GEO2R工具对GSE12470数据集进行差异分析,发现在早期卵巢癌和正常样本中2555个差异上调基因和2310个差异下调基因(图2A)。在晚期卵巢癌和早期卵巢癌中921个差异上调和196个差异下调基因(图2B)。为挖掘在疾病进展中发挥作用的基因,对两组差异基因取交集,发现35个上调基因和2个下调基因(图2C, D)。
图2 卵巢癌差异基因识别
2. 卵巢癌候选基因表达的验证和生存分析
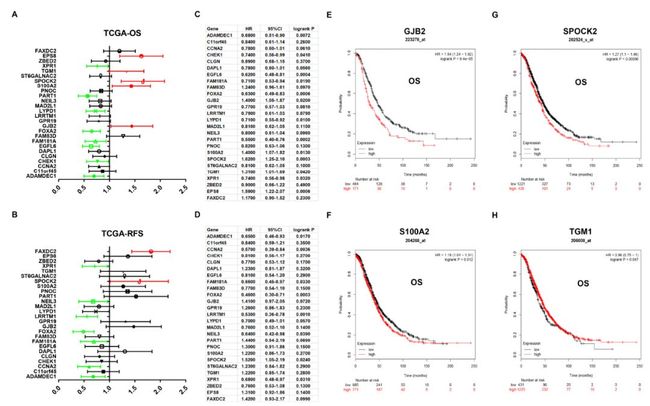
为了提高识别卵巢癌相关基因的准确性,利用GEPIA数据库对卵巢癌在TCGA和GTEx数据集中进行差异基因识别,发现之前识别的37个差异基因中26个是差异表达的(图3)。且在TCGA数据集中,高表达GJB2, S100A2, SPOCK2, TGM1具有不良预后(图4A)。且候选基因的表达对OS和RFS也具有关联性(图4A-D)。在TCGA和GEO数据集中,GJB2, S100A2和SPOCK2的高表达患者均有较差的预后(图4E-G,这是原文:ovarian cancer patients with higher expression of GJB2, S100A2 and SPOCK2 showed better OS,但是图中展示高表达预后更差)。在GEO数据集中,TGM1的高表达患者有着更好的预后(图4H)。
图3 26个关键基因的表达箱式图
图4 26个候选基因与预后的关联
3. hsa-miR-363-3p-SPOCK2证实是与卵巢癌进展相关的调控轴
利用miRNA靶预测算法(PITA、RNA22、miRmap、microT、miRanda、PicTar和TargetScan)预测调控GJB2, S100A2和SPOCK2的靶miRNA,分别识别了8, 6和20个靶miRNA(图5A-C)。对靶miRNA的表达与生存进行关联分析发现一些miRNA的表达与生存显著相关,例如hsa-miR-522-3p(图5D-F)。最后,计算miRNA与靶基因之间的表达相关性,发现miR-363-3p-SPOCK2调控轴是显著负相关的(图5G-L),最终留下miR-363-3p-SPOCK2调控轴进行后续分析。
图5 卵巢癌候选基因上游靶miRNA识别,生存分析以及相关性分析
4.hsa-miR-363-3p-SPOCK2轴参与肌动蛋白细胞骨架的调节
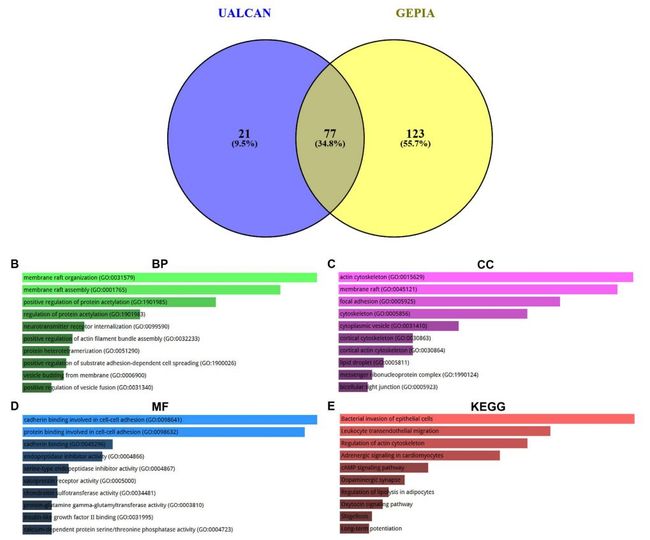
利用UALCAN和GEPIA进行计算SPOCK2的共表达基因,发现77个基因在两个数据集中共同出现(图6 A)。利用Enrichr对77个共表达基因进行功能富集分析,发现参与一些actin cytoskeleton等细胞组分,以及cell-cell adhesion的分子功能等(图6B-E)。
图6 与SPOCK2共表达基因的富集分析
5. hsa-miR-363-3p上游潜在假基因和lncRNA
利用starBase数据库预测hsa-miR-363-3p调控的lncRNA和假基因,预测得到56个假基因(图7A)。对假基因进行差异分析,发现6个假基因显著上调(图7B-G)。接着在不同stage的卵巢癌病人中评估假基因的差异情况(图7H-M),发现在晚期卵巢癌中高表达。计算假基因和miRNA的相关性,发现RPS26P15与hsa-miR-363-3p显著负相关,虽然一些其他的假基因相关性并不显著,但是仍旧呈现负相关性(图7N-S)。
图7 hsa-miR-363-3p上游假基因的识别
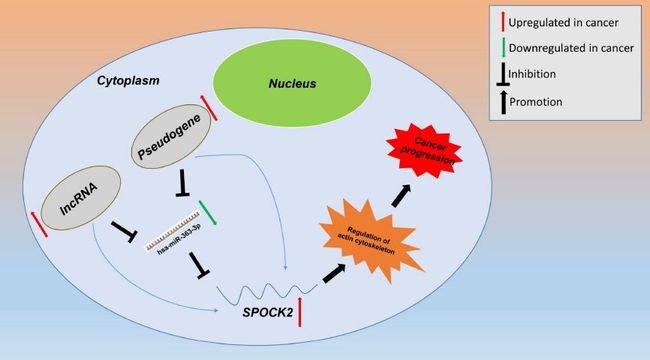
再利用starBase和miRNet进行hsa-miR-363-3p靶lncRNA的识别(图9A),发现8个hsa-miR-363-3p上游调控的lncRNA(图9)。这些lncRNA或假基因的上调可能和卵巢癌的进展有关(此处为何不对lncRNA计算相关性?)。并且推测卵巢癌中假基因/lncRNA-hsa-miR-363-3p-SPOCK2潜在的调控机制(图9)。
图8 hsa-miR-363-3p上游lncRNA的识别
图9 假基因/lncRNA-hsa-miR-363-3p-SPOCK2调控轴的机制图