Butler-Volmer方程推导
Butler-Volmer方程推导
Derivation of Butler-Volmer Equation
阿伦尼乌斯Svante Arrhenius在1889年通过实验经验提出了化学反应速率常数Reaction Constant与活化能Activation Energy 和温度的关系:
其中
k k 是反应速率常数;
T T 是反应温度,K;
A A 是指前因子;
Ea E a 反应活化能;
R R 气体常数;
1935年 Henry Eyring, Meredith Gwynne Evans 和 Michael Polanyi基于过渡态理论,通过统计热力学方法得到了类似于Arrhenius 方程的形式,称作Eyring–Polanyi 方程:
其中
k k 是反应速率常数;
T T 是反应温度,K;
A A 是指前因子;
ΔG‡ Δ G ‡ 是反应吉布斯活化能Gibbs Energy of Activation;
R R 气体常数;
这里指前因子的表达式:
其中
κ κ 是透过系数transmission coefficient;
kB k B 玻尔兹曼常数
T T 是反应温度,K;
此处可以简单的认为活化能等于吉布斯活化能。
假设一单电子基元反应Elementary reaction,没有中间产物intermediates,其反应式如下:
正向反应是阴极cathodic(还原)反应,其反应速率常数为 kc k c ;逆反应是阳极Anodic(氧化)反应,其反应速率常数记作 ka k a 。
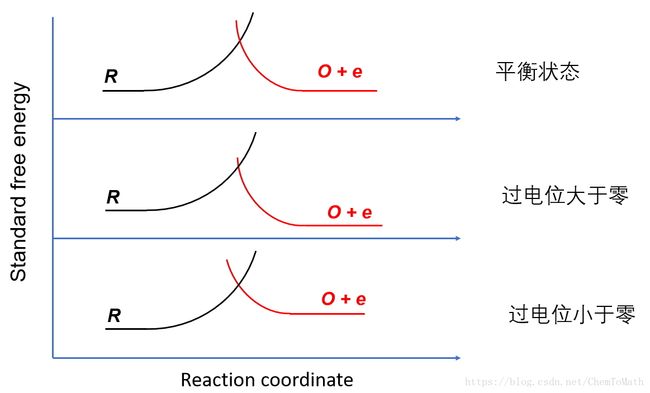
通过改变施加的电压,只是改变了电子的势能,因此改变外加电压会改变 [O+e] [ O + e ] 的能量,会使 [O+e] [ O + e ] 的能量曲线整体上移或下移,这样在交叉点就形成了过渡态,如Figure 1所示。
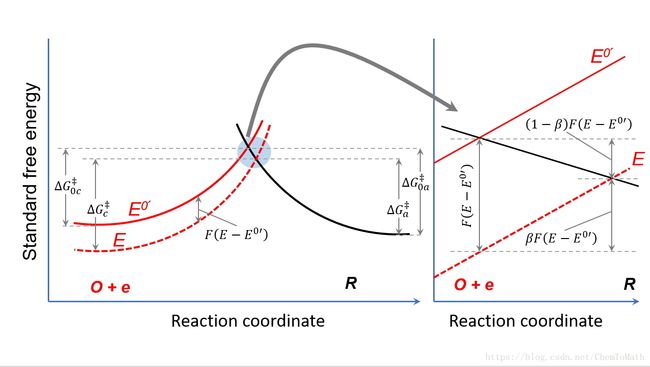
Figure 2. 外电压对正逆反应的影响。
如Figure 2所示,选择标准电位 E0′ E 0 ′ 作为参考点。此时,正向反应 O+e→R O + e → R 的活化能为 ΔG‡0c Δ G 0 c ‡ ,逆向反应 R→O+e R → O + e 反应活化能 ΔG‡0a Δ G 0 a ‡ 。此时外加电压增加一个小量 ΔE Δ E 变为 E E ,变化的电场只改变电子的能量,电子能量变化了 −FΔE=−FΔ(E−E0′) − F Δ E = − F Δ ( E − E 0 ′ ) ,Figure 2.中的红虚线就是代表正的 ΔE Δ E 使得电子能量降低,从而曲线整体下移。那么在电压 E E 下,正向反应的活化能是 ΔG‡c Δ G c ‡ ,逆向反应的活化能是 ΔG‡a Δ G a ‡ 。如何定量计算新电压下的活化能,新电压下的正逆反应活化能的变化和整体能量变化 −FΔE=−FΔ(E−E0′) − F Δ E = − F Δ ( E − E 0 ′ ) 有什么定量关系?我们看一下交叉区域,在比较小reaction coordinate的范围内我们可以认为红实线和红虚线都是直线且平行,也可以认为R曲线在那一小的范围内为直线。基于这一近似,从图中我们可以看到整体能量的变化等于正逆向反应活化能变化的加和。定义正向反应的活化能变化是一个系数 β β 乘以总能量变化 βFΔ(E−E0′) β F Δ ( E − E 0 ′ ) ,那么逆反应的活化能变化为 (1−β)FΔ(E−E0′) ( 1 − β ) F Δ ( E − E 0 ′ ) 。因此,在电压 E E 下,正逆向反应活化能为:
根据Arrhenius equation得到正逆向反应的反应速率常数
把(4)与(5)活化能表达式分别带入到(6)与(7)式中,得:
从(8)与(9)式能看出,当 E=E0′ E = E 0 ′ 时,即在平衡电位、平衡状态下的正逆反应速率常数分别是:
此时再假定一特殊情况,电极处于平衡状态,且在电极表面的反应物与产物的浓度相等,即
正逆反应速率相等:
综合(12),(13)式,得标准反应速率常数standard rate constant:
那么,在其它电压 E E 下,正逆反应速率常数分别为
那么根据反应速率和电流的关系
可得到
则净电流为 i=ic−ia i = i c − i a ,可得Bulter-Volmer equation:
此处把标准电位 E0′ E 0 ′ 的参考点替换为平衡电位 Eeq E e q ,定义过电位Overpotential η=E−Eeq η = E − E e q ,(19)式可以写成电流与过电位的关系式 η−i η − i
注:Bulter-Volmer 方程的推导,基于很多的假设,一定要在假设前提下,才能应用此表达式。
参考文献
[1] Allen J. Bard, Larry R. Faulkner; Electrochemical methods-Fundamentals and applications.