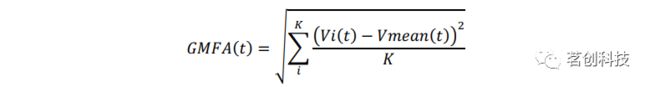Biological Psychiatry:利用TMS-EEG识别难治性抑郁症间歇性θ脉冲刺激的神经生理标志物
前言
难治性抑郁症(TRD)是指在经过足够疗程的药物治疗或心理治疗后,症状没有得到改善的重度抑郁。大约有30%的重度抑郁症(MDD)属于难治性抑郁症。重复经颅磁刺激(rTMS)可引起大脑皮层兴奋或抑制性的改变,是TRD的有效干预措施。间歇性θ脉冲刺激(iTBS)一般采用连续多个的50Hz频率的短阵脉冲,以5Hz频率重复发放短阵脉冲。iTBS作为FDA批准的rTMS范式,比传统的rTMS具有更明显的神经生理调节作用,尤其是对学习和记忆的改善。当iTBS作用于左背外侧前额叶皮层(DLPFC)时,TRD的有效率约为50%,缓解率约为32%,但其确切的神经生理效应尚不清楚。
为探究iTBS治疗TRD的神经生理机制,本研究采用了三盲随机对照的研究设计,对比不同参数的设置下(分离模式(两个600次脉冲,间隔54min)和连续模式(两个连续的600次脉冲,间隔0min))iTBS的疗效。对治疗前后的脑电信号进行比较,尤其是N45和N100振幅。此外,该研究还对iTBS有反应者和无反应者的EEG标记物进行了比较。目的是探究iTBS的神经生理效应与TRD治疗效果之间的关联,并对EEG信号对临床疗效的预测性能进行评价。
方法与材料
被试招募与研究设计
本研究数据来自于一项三盲随机对照的临床试验(NCT02729792)。纳入标准为:年龄18-59岁,符合简明国际神经精神访谈(MINI)的MDD标准,汉密尔顿抑郁评定量表(HRSD-17)评分≥18,筛查前4周精神药物未变动,使用足够疗程且≥1种抗抑郁药物治疗后临床症状未缓解,或者不耐受≥2种抗抑郁药物的单独试验。
为期6周的iTBS(30次治疗,每周5天),刺激部位为左侧DLPFC。参与者被随机分为两组,第一组为连续刺激组,参数设置为两次iTBS,每次600次脉冲,间隔0分钟。第二组为间隔刺激组,两次iTBS,每次600次脉冲,间隔54分钟。假实验组确保盲化。磁刺激强度设置为120%静息运动阈值(RMT)。首先是3次50Hz的脉冲刺激,之后为5Hz的重复刺激,占空比为2s开,8s关,总共600个脉冲,持续时间为189s。对于TMS-EEG和iTBS,采用蒙特利尔神经学研究所(MNI-152)坐标[x-38,y+44,z+26]对参与者的左侧DLPFC进行定位。(研究流程详见图1)
图1.研究设计概述。(A)研究设计。(B)TMS-EEG处理步骤。首先是预处理,接下来是两轮独立成分分析,以排除眨眼、侧眼运动、肌肉伪影和电极噪声,然后对每个TMS诱发电位进行视觉质量检查,以剔除残留的伪影。(C)纳入TMS-EEG参与者的流程图。
经颅磁刺激实验程序
使用7cm八字形线圈和通过Bistim模块连接的两个Magstim 200刺激器(Magstim Company Ltd,UK),对左侧DLPFC(BA9/46)施加100次单相TMS脉冲。
在首次iTBS治疗前和两次TMS-EEG治疗期间(即基线和iTBS治疗后)评估静息运动阈值(RMT)。在脑电帽定位前和定位后测定左侧运动皮层的RMT,定义为10个试次中有≥5个试次诱发运动电位的最小强度>50μV。每次治疗均以120% RMT进行。在iTBS开始前48小时和结束后7天内收集TMS-EEG数据。所有参与者都接受了相同的TMS-EEG测量,并对受试者治疗前后和组间数据进行分析。
脑电图记录与分析
使用64通道的脑电帽记录EEG,电极放置在每只眼睛的外角以及左眼上方和下方,以监测眼球运动。参考电极为Cz后方的顶点电极,采样率为20kHz,使用直流和300Hz的低通滤波器记录EEG信号,以避免放大器出现饱和失真,并减少TMS相关伪影。
脑电图处理由与治疗组无关的研究者使用EEGLAB和定制的MATLAB脚本(R2013a,The Mathworks,USA)进行。TMS脉冲数据分段(-1000至1000ms),基线校正(-1000至-110ms),去脉冲特征(-2至20ms)并进行线性插值。EEG数据降采样至1kHz,并目测检查极端噪声(即坏导,肌肉运动)。第一轮独立成分分析(ICA)去除TMS尾部和肌肉伪影,随后进行带通滤波(1-50Hz)。第二轮ICA去除了包括眨眼和眼球运动在内的伪影。数据重参考为平均参考。(关于数据集纳入/排除的信息详见图1)
全局平均场振幅分析(GMFA)
采用全脑分析法(GMFA)来量化神经生理反应,使用到的公式改编自Lehmann和Skrandies(1980)。对所有电极的TEP下面积(GMFA-AUC)进行计算,可以量化大脑对TMS的整体反应(GMFA公式如下)。
GMFA-AUC是指TEP在55ms到275ms之间的振幅之和。在分析前计算GMFA各成分的峰振幅和潜伏期并进行目测检查。计算TMS脉冲后不同时间范围的峰值振幅:N45(35-55ms),N100(80-120ms)。
感兴趣的临床变量
临床疗效评估主要是考察HRSD-17从基线到治疗结束的变化。独立评分者对治疗组进行盲测。分类结果变量包括有效率(HRSD-17降低≥50%)和缓解率(治疗后和1周随访HRSD-17<8)。
统计分析
采用R统计软件进行统计分析。采用优势比评估不同治疗组之间的差异,包括性别、惯用手,治疗疗效、药物使用情况。双样本t检验用于评估不同治疗组在平均年龄、受教育年限、MDD发病年龄、发作持续时间、基线和治疗后HRSD-17评分方面的差异。
神经生理结果分析
对TEP成分(N45、N100)与人口学变量(包括年龄、RMT、睡眠时间、种族、教育程度、发病年龄、发作时间,以及TEP中N100成分的潜伏期)进行了相关性分析。使用Mann-Whitney U检验比较分类变量间TEP成分的差异,分类变量包括治疗方式、性别、苯二氮卓类药物、咖啡因、酒精或尼古丁的使用情况。Mann-Whitney U检验对治疗组和反应组之间的ΔTEP振幅差异(iTBS后减去基线)进行了比较。配对样本Wilcoxon检验确定了治疗组和反应组iTBS后的振幅变化。线性混合模型检查了治疗组(时间×治疗)和反应组(时间×反应)之间N45和N100振幅的变化。对振幅进行对数变换,以满足模型假设。采用Bonferroni校正进行事后多重比较。
临床结果分析
采用Logistic回归分析探究GMFA振幅(即N45、N100振幅和GMFA-AUC)与疗效之间的关系。为了确定应将哪些变量纳入回归模型,对GMFA各成分与结果变量(即HRSD-17、性别、年龄)进行Spearman或Pearson相关分析(视情况而定)。之后将HRSD-17作为连续变量,并以显著相关性作为预测变量进行多元回归分析。对基线N100振幅和治疗后HRSD-17评分(10000个自举样本)进行探索性分析,以确定相关系数的95%置信区间。
结果
人口统计学和临床变量
两组患者在人口学基本信息以及基线HRSD-17评分、治疗后HRSD-17评分等方面均无显著差异。尽管差异无统计学意义,但在间隔刺激组中有反应者的比例更高(优势比(OR)=2.09,p=0.06)。此外,间隔刺激组中苯二氮卓类药物和兴奋剂的比例较高。相关分析显示,治疗后HRSD-17评分与iTBS治疗天数、重度抑郁发作(MDE)时长、苯二氮卓类药物使用等情况相关(详见表1)。
表1.患者人口统计学和临床特征。
神经生理学变量
治疗组在基线和治疗后(表2)或反应组在基线和治疗后(表3)之间的RMT无显著差异。在治疗前后,无论是间隔刺激组还是连续刺激组、有反应组还是无反应组的RMT均无显著变化。基线和iTBS后RMT的散点图显示有反应者和无反应者之间没有差异。基线N45振幅或潜伏期、N100振幅或潜伏期、GMFA-AUC之间无差异,治疗组之间ΔN45振幅或潜伏期、ΔN100振幅或潜伏期、ΔGMFA-AUC也无差异(表2)。
表2.间隔刺激组vs.连续刺激组的神经生理学变量。
表3.有反应组vs.无反应组的神经生理学变量。
GMFA分析
N45振幅
从基线到治疗后,间隔刺激组和连续刺激组的N45振幅总体上没有变化。考虑到线性混合模型中的RMT,两组在基线或iTBS后的N45振幅没有显著差异(图2)。治疗后有反应者的平均N45振幅更高(图3)。控制RMT后的线性混合模型显示时间-反应交互作用显著,经Bonferroni校正的两两比较显示,治疗后有反应组的N45振幅高于无反应组(图4)。然而,有反应组和无反应组的N45振幅从基线到治疗后的变化并不显著。有反应组和无反应组在ΔN45上无明显差异。基线与治疗后的N45振幅与临床变量之间无显著相关。
图2.(A)间隔刺激组和(B)连续刺激组在基线和iTBS后的GMFA。
图3.(A)有反应组和(B)无反应组在基线和iTBS后的GMFA。
图4.有反应组和无反应组在基线和iTBS后的N45振幅。
N100振幅
治疗后的N100振幅显著下降(P=0.04),间隔刺激组亦是如此(P=0.02)(图2)。线性混合模型显示,时间-治疗交互作用不显著。在整个样本中,iTBS后N100振幅显著降低。治疗后有反应组的N100振幅下降,而无反应组的N100振幅无显著变化(图3)。有趣的是,ΔN100在有反应组和无反应组之间的大小和方向不同。在有反应组中,N100更负向;在无反应组中,则更正向。线性混合模型显示N100振幅的反应-时间交互作用显著,事后检验显示有反应组的N100振幅下降,而无反应组的N100无显著变化(图5)。
图5.整个样本(左)以及有反应组和无反应组(右)在基线和iTBS后的N100振幅变化。
基线期N100振幅与HRSD-17的得分呈负相关,当考虑到治疗次数、MDE时长和苯二氮卓类药物时,较高的基线期N100振幅与较低的治疗后HRSD-17得分有关。基线N100振幅每增加1µV,HRSD-17得分下降0.93。基线N100振幅与临床结局之间没有显著关联。
GMFA曲线下面积(GMFA-AUC)
总体而言,不同治疗组在iTBS治疗后GMFA-AUC无显著变化。女性参与者在基线期的GMFA-AUC更高。在基线时,服用苯二氮卓类药物的受试者GMFA-AUC较低。治疗后GMFA-AUC与RMT呈正相关。在线性混合模型中,不同治疗组之间的GMFA-AUC没有差异。有反应组在基线期显示出更高的GMFA-AUC。性别、苯二氮卓类药物使用和RMT对GMFA-AUC没有显著影响。较高的基线GMFA-AUC与较低的治疗后HRSD-17得分相关。基线GMFA-AUC每增加1µV, 则HRSD-17下降0.006。在整个样本中,基线GMFA-AUC与临床结局之间无显著相关。
探索性分析
有反应组(n=34)的ΔN100振幅比无反应组(n=56)更容易被归类为“负性”。无反应组的ΔN100振幅比有反应组更容易被归类为“正性”。有反应组和无反应组表现出“无变化”的比例没有差异。
药物分析
服用苯二氮卓类药物或兴奋剂的受试者更多。在有反应组中,苯二氮卓类药物或兴奋剂的使用没有差异。排除个人处方苯二氮卓类药物以及兴奋剂对TEP标记结果没有影响。将苯二氮卓类药物和兴奋剂的使用作为线性混合模型中的协变量并不影响结果。
结论
本研究提供了治疗性iTBS对TRD患者DLPFC神经生理影响的证据,根据本研究的结果,iTBS影响了抑制性神经传递,特别是诱导了N100振幅的下降。这种效应存在于整个样本中,尤其是有反应组的N100振幅持续下降,而无反应组则表现出广泛的可变性。iTBS治疗后,N100振幅下降与抑郁症状的缓解一致,表现出神经生理和临床反应之间的同步性。据所知,本研究分析了TRD中迄今为止最大的TMS-EEG数据集,提供了iTBS诱导TRD中TMS-EEG标记物变化的首个证据。研究发现无论连续发放脉冲还是间隔发放脉冲,TEP成分没有显著差异。iTBS后N100振幅下降,尤其是在有反应组中,这说明iTBS可能部分通过GABA能的改变来发挥抗抑郁作用。此外,基线N100振幅与iTBS治疗后抑郁症状的改善有关,未来应当进行更深入的研究,以进一步确定如何将该测量作为可靠的神经生物学标志物,用于TRD患者的疗效预测。
原文:Strafella R., Momi D., Zomorrodi R., Lissemore J., Noda Y., Chen R., Rajji T.K., Griffiths J.D., Vila-Rodriguez F., Downar J., Daskalakis Z.J., Blumberger D.M. & Voineskos D., Identifying Neurophysiological Markers of Intermittent Theta-Burst Stimulation in Treatment-Resistant Depression using Transcranial Magnetic Stimulation- Electroencephalography, Biological Psychiatry (2023), doi: https://doi.org/10.1016/j.biopsych.2023.04.011.