微生物-肠道-脑轴:新的治疗机会
传统的药理学和毒理学领域开始考虑肠道微生物群对宿主生理的影响。微生物群-肠-脑轴正在成为一个特殊的关注领域,是有效治疗中枢神经系统疾病的潜在新靶点,同时也是药物副作用的潜在原因。
微生物-肠道-脑轴信号可以通过多种途径发生,包括通过免疫系统、宿主神经化学信号的募集、肠道神经系统和迷走神经的直接途径,以及细菌代谢物的产生。在一些精神和神经疾病中肠道微生物谱的改变已被报道。神经生物制剂,活体生物治疗制剂或对大脑有益的物质是由细菌介导的,目前正在研究作为精神和神经发育障碍以及可能的神经退行性疾病的直接和/或辅助疗法,它们可能会成为临床治疗脑疾病的新选择。本文发表在Annual Review of Pharmacology and Toxicology。
介绍
一个人的身体和他的思想,对这两者都怀着极大的敬意,就像一件上衣和上衣的衬里一样——弄皱这一件,也就弄皱了另一件。——劳伦斯·斯特恩(1759),《特利斯特拉姆·姗蒂的生活和观点》
在斯特恩的巨著问世260年后的今天,以身体而非大脑为治疗目标来治疗神经疾病的概念,即使在现在看来,也可能显得古怪。然而,在过去的十年里,它受到了很大的关注。事实上,越来越明显的是,生物学家必须将微生物群的影响纳入生理学的考虑,包括药物给药后的药代动力学和药效学。身体里微生物群的数量大约是我们人体细胞的1.3倍,由大量的细菌、酵母和寄生虫(如蠕虫、病毒和原生动物)组成。目前,我们对细菌种群了解最多,尤其是胃肠道内的细菌。然而,当涉及到阐明这些微生物对宿主健康的确切影响时,我们并不清楚。每个个体的肠道菌群确切组成是不同的,除了表现出多样性和稳定性,目前还不清楚究竟是什么构成了一个健康的成人肠道菌群。这些共生肠道微生物,即自然存在于肠道中的微生物,在很大程度上与其宿主的共生关系比共生一词所暗示的更为密切。它们在消化中有几个重要的作用,包括发酵未消化的碳水化合物,产生维生素和二级胆汁酸,以及免疫系统的发育。然而,我们需要考虑肠道微生物群的影响,特别是在药理学和毒理学领域。
这些领域传统上集中于药物的直接吸收、分配、代谢和排泄,以及这些药物与宿主中的靶点、转运体或酶的相互作用,从而产生有益和不良的副作用。我们现在还必须考虑到,肠道微生物群,特别是口服药物的情况下,可以影响药物的代谢,并成为药物反应的关键效应。当以不利的形式存在时,或在入侵致病菌的情况下,其本身就具有毒性,我们也有可能直接针对肠道微生物群来治疗越来越多的疾病,而肠道微生物群代表了令人兴奋的新治疗机会。在本文中,我们聚焦于细菌肠道微生物群,以影响微生物-肠道-脑轴信号,从而有效治疗中枢神经系统(CNS)疾病。然而,值得注意的是,病毒群和真菌群也在微生物-肠-脑轴信号中发挥作用。
微生物-肠道-脑轴
肠道微生物群的简介
就饥饿和饱腹感信号的中央控制以及在短期内调节食物摄入的源自肠道的因素而言,肠-脑双向沟通的存在似乎是显而易见的。但越来越明显的是,这种交流涉及更广泛的认知、社会行为,恐惧表达和压力反应。行为的改变与胃肠道疾病和胃肠道功能性疾病(没有明显的胃肠道病理,但有很高的心理紊乱的成分)有关,并可能导致严重的胃肠道不适。此外,急性和慢性压力、焦虑和抑郁都受到肠道微生物谱的影响,而肠道微生物谱本身受到多种因素的调节。该领域的大多数研究人员认为,肠道微生物的定植主要发生在出生时,婴儿体内的微生物种群最初类似于母亲的产道。剖腹产与分娩相比,肠道微生物显著不同,前者包含皮肤和分娩套上的微生物,这些婴儿双歧杆菌、拟杆菌和乳酸菌的定植率较低。后者更接近于母亲阴道微生物群。在出生后两年内,剖腹产分娩婴儿的肠道微生物组与经阴道分娩婴儿的肠道微生物组更接近。然而,差异种群的功能效应可能会持续,并认为可能与儿童肥胖和哮喘的相对风险增加有关。
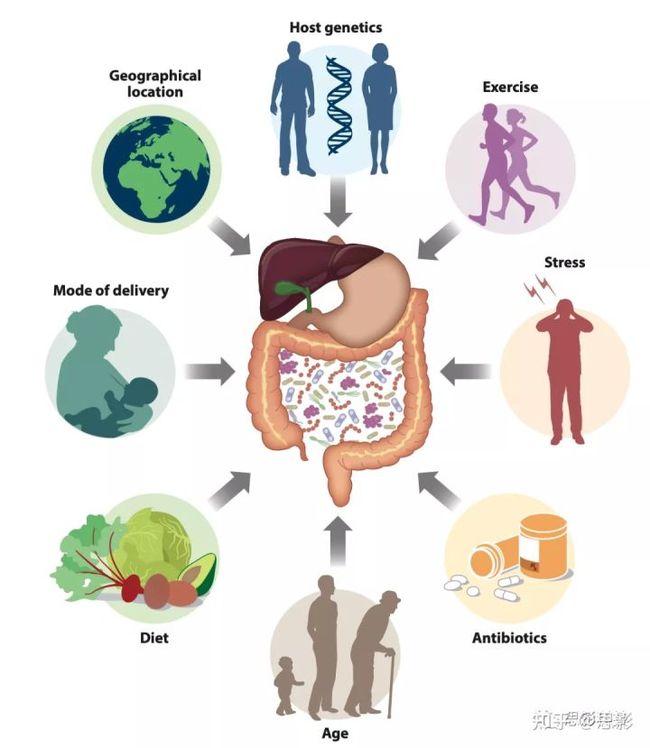
此外,生命早期肠道微生物的组成还受到多种因素的影响,包括产前抗生素使用、母乳喂养、生命最初几年的生长地理位置的影响。在整个生命周期中,肠道微生物组的组成进一步受到饮食、地理、运动水平、抗生素使用和其他药物使用的影响(图1)。饮食在肠道微生物的组成和多样性中发挥着巨大的作用。饮食的改变会导致肠道微生物谱的快速变化。地中海饮食与特定的肠道微生物组成和一系列有益健康的影响有关。不良饮食的有害影响,包括西式饮食对肠道微生物群的影响与代谢综合征发病率的上升有关。
图1影响肠道微生物群分布的因素。多种因素可能会对整个生命周期中肠道微生物群的组成和多样性产生积极和消极的影响。
微生物-肠道-大脑轴通讯背后的信号机制
微生物-肠道-脑轴的信号传导可以通过多种机制发生。肠道微生物可以产生生物活性肽,包括神经递质,次级胆汁酸的转化,短链脂肪酸(SCFAs),支链氨基酸和肠道激素,短链脂肪酸包括乙酸、丁酸、丙酸和乳酸,可以进入循环系统,它们可能通过这一途径向大脑发出信号。微生物也可以介导色氨酸的代谢,从而在某些情况下调节血清素信号。多巴胺、去甲肾上腺素、GABA和乙酰胆碱也可以由肠道微生物合成。肠壁由肠神经系统(ENS)丰富的神经支配,主要负责肠道的运动,神经递质和SCFAs可以控制肠道壁。此外,微生物相关的分子信号,可以被ENS中的toll样受体识别。事实上,免疫信号是微生物-肠道-大脑信号发生的一个重要机制。肠道还含有大量的免疫细胞,它们在肠道上皮的黏液层的物理屏障之后,为病原体提供了第二道防线。肠道微生物群会影响促炎和抗炎细胞因子的产生,然后通过循环系统向大脑发出信号。肠道屏障的通透性也可能在应激期间受到负面影响。
迷走神经与微生物群-肠道-大脑轴信号密切相关,是肠道和大脑之间通信的关键模式之一。迷走神经切开术是一种治疗消化性溃疡的外科手术,在目前广泛使用的药物和幽门螺杆菌在该疾病中的作用之前,这种手术被广泛使用,它与降低帕金森病(PD)的发展风险有关。相反,在临床前研究中,在迷走神经切开术后,鼠李糖乳杆菌的许多有益作用被取消了,迷走神经刺激被用于治疗抑郁症。最近,通过光遗传刺激,有一个肠-脑轴迷走神经通路到达中枢神经系统奖励神经元。肠内分泌细胞释放的谷氨酸可以激活迷走神经,而血清素也更普遍参与其中。
大脑疾病中的肠道微生物谱改变
在临床模型中观察到肠道微生物谱的改变。在阿尔茨海默病(AD)和PD患者以及抑郁症、自闭症和创伤后应激障碍(PTSD)患者中,肠道微生物谱的差异已被注意到,本节将详细描述。此外,抑郁症患者的粪便微生物谱移植(FMT)导致抑郁症表型从患者转移到临床模型,强化了这一概念,即这些疾病中肠道微生物的改变可能对表型有直接影响。
压力
压力应激过程在改变肠-脑轴中起着重要作用。急性应激直接激活HPA(下丘脑-垂体-肾上腺)轴,以对激活源作出适当反应。然而,长期的、慢性的应激会导致HPA轴激活异常增加。有大量的临床证据描述了包括啮齿动物和非人灵长类动物在内的几种宿主的微生物菌群-肠道-脑轴的应激诱导改变。此外,通过接触抗生素、缺乏母乳喂养、剖腹产、感染、压力暴露和其他环境因素,以及宿主基因,能够改变生命早期的微生物状况,可以影响与应激相关的生理和行为,无菌动物肠道菌群的缺失会导致异常的应激反应。在人类中,关于肠道微生物谱与特定压力相关的改变的研究很少。然而,许多研究已经描述了肠易激综合征(IBS)等胃肠道疾病的肠道微生物谱的改变。孕妇暴露在产前压力下,除了造成婴儿后期的胃肠道症状和过敏反应外,还会导致婴儿肠道微生物谱的改变。目前在对肠道微生物群的研究中验证,通过不良生活习惯和暴露于压力和焦虑也会影响与压力相关的抑郁状态。
重度抑郁症
有一些研究发现与健康对照组相比,重度抑郁症(MDD)患者肠道微生物谱显著改变。不同的研究发现了增加和减少的微生物种类,其中大多数研究描述了粪便微生物丰富度的减少。关于MDD中肠道微生物群作用的进一步证据来自两项描述MDD患者FMTs(粪菌移植,Fecal microbiota transplantation,FMT)的研究,将MDD转化为焦虑和抑郁表型。最近一项关于肠道菌群项目的大规模研究也确定了抑郁症患者的肠道菌群存在差异,这些差异在考虑了抗抑郁药物的交互效应后仍然存在。粪球菌和小杆菌属物种在抑郁组中不存在,它们在非抑郁组中的存在与生活质量评分呈正相关,尽管人们已经注意到后者评分并不能完全代表抑郁本身。
帕金森病
许多不同的研究已经描述了PD患者肠道微生物谱的改变。前期症状与肠道相关,主要表现为便秘,经常在将继续发展为帕金森病的患者中被描述,而帕金森病的病因被认为是从肠道开始的。事实上,从PD患者到PD小鼠模型的FMT(粪菌移植)会导致运动缺陷和神经炎症,这进一步证明了肠道微生物群与PD有关。流行病学研究表明,接受完全性迷走神经切断术治疗消化性溃疡的患者随着年龄增长患帕金森病的风险降低,并为可能涉及的肠道-大脑信号通路提供了一些见解。幽门螺杆菌对帕金森病症状学的负面影响已被描述,最近的一项荟萃分析确定根除幽门螺杆菌有明显的好处,这对改善PD症状的作用。
阿尔茨海默病
AD也被认为与肠道微生物谱改变有关,在轻微的AD患者中发现菌群丰富度和多样性降低,以及厚壁菌门与拟杆菌门比率的差异,这在之前的肥胖研究中有过描述,并为AD和2型糖尿病(T2DM)之间的联系提供了有趣的类比。最近研究发现,与认知正常的老年人相比,AD患者和轻度认知障碍患者的血清中存在不同水平的二级胆红酸,二级胆红酸由肠道微生物代谢而来,这与脑病理有关。此外,肠道微生物谱的改变与其他健康老年人的认知障碍以及淀粉样蛋白-β负荷有关。
其他大脑疾病
关于肠道菌群对精神分裂症影响的研究有限,但精神分裂症确实包含肠道微生物疾病症状。也有初步证据表明,白色念珠菌的存在与男性精神分裂症患者更严重的精神症状有关。最近的一项研究描述了与精神分裂症严重程度相关的特定类群,包括绒毛藻科和毛螺藻科。此外,将这些精神分裂症患者的FMT(粪菌移植)移植到无菌小鼠中,除了改变谷氨酸信号之外,还会引起精神分裂症表型。
自闭症谱系障碍(ASD)患者经常出现肠道相关的共病,事实上,不寻常的饮食模式在ASD患者中经常发生。一些研究已经描述了ASD患者肠道微生物谱的改变,他们特别强调了双歧杆菌丰度的减少,双歧杆菌被认为是一个有益的属。此外,这些研究还描述了梭状芽胞杆菌(一种潜在致病属)的丰度增加。在一项短期研究中,广谱抗生素万古霉素治疗导致行为症状的积极改变,进一步强调了ASD中肠道微生物谱异常改变的作用。此外,在一项开放式研究中,从健康个体到ASD患者的FMT导致了肠道疾病和行为的改善。
最近一项关于双向情感障碍患者肠道微生物概况的小型研究表明,这些患者的差异有限。然而,患者肠道微生物的某些属与睡眠和应激状态之间存在一定的相关性。最后,有初步证据表明,创伤后应激障碍患者的肠道微生物谱也发生了改变。
以治疗为目标的微生物-肠道-大脑轴
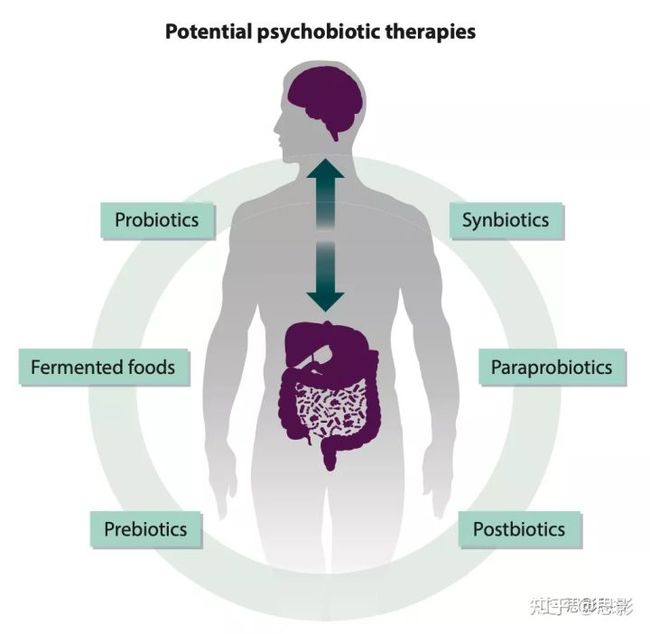
考虑到肠道菌群在这些大脑相关疾病中所起作用的新证据,现在肠道菌群被作为调节有益大脑影响的目标也就不足为奇了。心理生物制剂一词是Dinan等人在2013年创造的,是一类新型精神药物,被定义为“一种活的微生物,当摄入足够的量时,对精神疾病患者的健康有益。”这个定义后来被扩展到包括“任何细菌介导的外源性对大脑的影响”。因此,精神生物制剂可以包括一系列影响微生物-肠道-脑轴信号的物质,包括益生菌、益生元和生物制剂(图2)。这些物质可以通过补充剂、功能食品和改善饮食摄入来输送。值得注意的是,市场上最早的抗抑郁药物也是抗生素。
图2潜在的心理生物疗法。这些包括益生菌、活生物治疗剂、益生元、合生元、副益生菌、后生元和发酵食品。
益生菌
益生菌的定义是“活的微生物,当给予足够的剂量时,对宿主的健康有益”。益生菌最早是在100多年前埃利·麦特奇尼科夫(Elie Metchnikoff)的研究中被提出的,他描述了保加利亚贫困人口食用发酵牛奶中的乳酸菌对健康的益处。现在有大量的研究表明,在临床模型中,各种益生菌菌株在消除压力、抑郁和类似焦虑的行为方面有好处,此外,还有越来越多的成功的人类研究,显而易见的是,益生菌对健康的益处完全依赖于菌株,并不是所有的益生菌都对大脑有益(表1)。乳酸菌和双歧杆菌的菌株,具有明确的安全特性,经常被用作益生菌,这两属通常发现有有益的健康影响,但决定功效的最重要的是个别菌株的差异。此外,在临床模型中已证明有益的益生菌能否成功转化在人体研究还没有保证。益生菌通常不会在肠道中常驻,也就是说,益生菌需要每天食用才能保持积极的效果。一般来说,益生菌是食品的组成部分或作为食品补充剂提供。下一代益生菌,包括在美国正式被认定为活体生物疗法的益生菌,和没有使用历史但可能对健康有益的益生菌,可以通过更传统的药物途径而不是通过食品途径,并与更严格的监管相关。
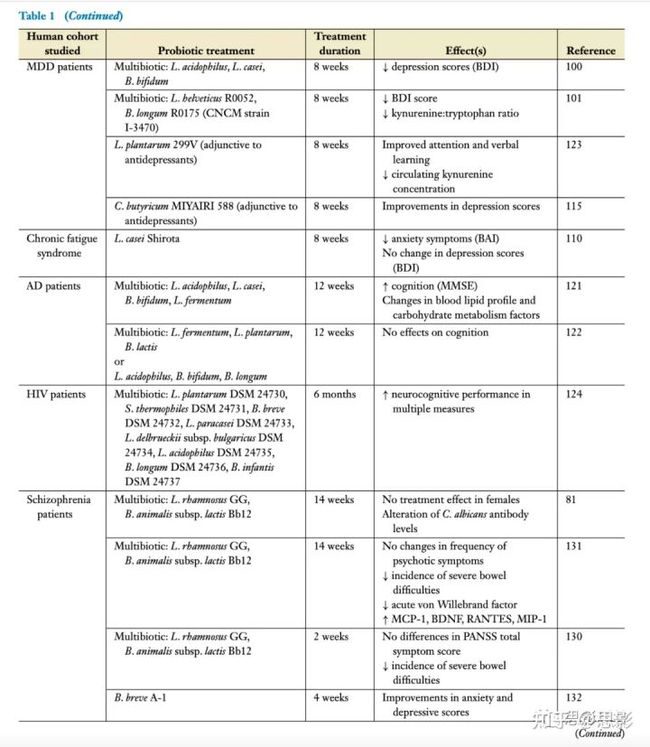
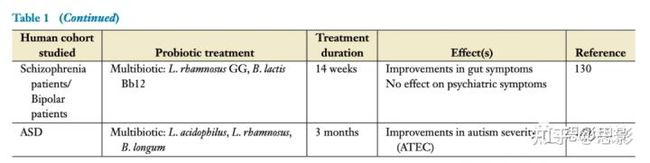
表1 益生菌对微生物群-肠-脑轴信号的研究
精神病学相关研究。在一些人类研究中,益生菌已被证明能在改善情绪和抑郁状态方面取得了一些成功。在一项双盲随机对照试验(RCT)中,用含有干酪乳杆菌的牛奶饮料进行治疗,结果在一组老年人中情绪评分改善,其中基线情绪评分最低的被试中获益最大。在一项随机对照试验中,三种菌株(嗜酸乳杆菌、干酪乳杆菌和两歧双歧杆菌)给予MDD病人为期8周的疗程,与安慰剂相比,抑郁自我报告量表得分得到了改善。而一项对一种乳杆菌和一种长双歧杆菌菌株的研究显示,抑郁症患者的抑郁评分有所改善。6周的干预在IBS(肠易激综合征)患者中导致抑郁的改善,而不是焦虑的评分。L. helveticus和B. longum也被描述有助于焦虑和应激反应,并且两种益生菌的减少影响个体的应激相关胃肠道症状。此外,一种多菌益生菌[嗜热链球菌(2株),保加利亚乳杆菌,乳酸乳杆菌,嗜酸乳杆菌,植物乳杆菌,乳酸双歧杆菌]最近被描述在健康对照组有焦虑作用,而另一种多菌益生菌(9种,包括乳酸杆菌和双歧杆菌)改善了健康对照组对悲伤情绪的认知反应。一个在怀孕期间服用鼠李糖乳杆菌菌株的随机对照试验验证了其显著降低了焦虑和产后抑郁的测量值。在其他方面,健康的学生在食用含有L. casei Shirota益生菌的发酵牛奶后,与考试相关的压力水平降低了。这种菌株以前被证明可以减少慢性疲劳综合征患者的焦虑症状。
在摄入L. plantarum 299v益生菌菌株的健康学生群体中,在考试压力期间观察到唾液皮质醇也减少了。此外,在一项益生菌干预研究中观察到抑郁和焦虑评分的改善,该研究在检测使用含有益生菌的酸奶组与单独使用标准酸奶组进行对比,发现这种改善与犬尿氨酸信号的改变无关。应激和唾液皮质醇的积极变化以及免疫反应的改善也在干预12周后被观察到。
加氏乳杆菌和长柄乳杆菌。最近的一项研究进一步描述了植物乳杆菌对有压力但健康的成年人的多种益处,包括减轻压力和焦虑,改善记忆和认知的多个方面,增强5 -羟色胺能信号,减少皮质醇和促炎细胞因子。
有趣的是,在一项开放标签研究中,益生菌也被研究为一种潜在的与抗抑郁药物联合使用的辅助疗法,在治疗一组难治性抑郁症患者方面显示出一些前景。这些发现获得了MDD患者中益生菌治疗潜力的系统综述的支持。另一方面,一些研究未能显示益生菌补充MDD患者在改善抑郁评分方面的任何益处,这确认了精神生物制剂的菌株依赖性,这在最近的一项系统综述中再次强调。
神经学相关研究。使用益生菌干预来改善AD导致的认知缺陷的研究数量有限。一项这样的随机对照试验,在牛奶饮料中使用多种益生菌(嗜酸乳杆菌、干酪乳杆菌、两歧杆菌和发酵乳杆菌),导致Mini–Mental状态测试分数的提高。然而,在同一组的另一项随机对照试验中,使用其他乳酸菌和双歧杆菌菌株的严重AD被试组中,没有观察到认知功能的改善。再次强调菌株水平在形成有效益生菌方面的不同作用,和对进展性疾病明确治疗干预的最佳时间的重要性。在最近的一项对MDD患者的研究中,由于补充了植物乳杆菌(L. plantarum),在注意力和语言学习测试中测量的认知表现得到了改善。在对124名HIV患者进行6个月的多菌益生菌干预后,认知能力也得到了改善。此外,在一组健康志愿者中,经过4周的多菌益生菌干预,情绪记忆表现得到了改善。
某些益生菌菌株在ASD临床前模型中显示出改善行为和神经化学紊乱的前景。在ASD中使用益生菌的人类研究还处于起步阶段,主要集中在肠道相关并发症的改善,尽管也有一些行为改变的初步证据。附加鼠李糖双歧杆菌治疗精神分裂症患者可改善肠道健康,但对精神症状严重程度无有益影响。通过对慢性精神分裂症患者进行14周的鼠李糖乳杆菌和动物乳杆菌的辅助治疗,也观察到外周炎症状况的改善。最近一项对精神分裂症患者补充短双歧杆菌的研究报告了对焦虑和抑郁评分的有益影响,尽管该研究没有安慰剂组。
益生元
已经做了大量的研究,试图通过将活的微生物,益生菌引入来直接调节肠道微生物群。然而,这种方法存在许多技术和实际困难。这包括确保益生菌在pH水平改变的恶劣环境中生存,从胃的酸性到碱性的胆汁盐环境,再到它能发挥潜在治疗作用的肠道位置,在环境中长期定植,易发酵性和批量生产问题,以及合适的菌株的选择。另外,针对有益的宿主微生物群并使这些细菌定植,现在有新的可能性。益生元的定义是“能被宿主微生物选择性地利用,从而有益于健康的物质”。在大多数情况下,益生元由菊粉、低聚果糖、低聚半乳糖(GOSs)和抗性淀粉等纤维组成,这些纤维在小肠中不能被吸收,而是被肠道微生物选择性发酵。益生元存在于各种各样的水果、蔬菜和谷物中,而这些物质在西式饮食中越来越少。
益生元也存在于母乳中(母乳寡糖)。与使用单株或多株益生菌相比,使用益生菌干预具有潜在的优势,能够在更广泛的范围内改善肠道微生物状况。
关于微生物-肠道-大脑轴,现在有多个使用益生元的研究产生了有益的结果。在健康被试中,给予为期3周的B-GOS治疗导致皮质醇反应降低,而另一项研究确定,在IBS(肠易激综合征)被试中,补充GOS导致焦虑得分显著降低。然而,其他研究未能找到证据表明益生元干预改善了MDD队列的情绪得分。当纳入限制性饮食干预时,B-GOS干预导致ASD儿童的行为改善。在最近一项研究中,一组精神分裂症或双相情感障碍患者服用稳定的非典型抗精神病药物后,肠道微生物谱发生了变化,该研究旨在检验益生元在该人群中的耐受性。
合生素
合生素是益生菌和益生元的组合,益生元的作用是提高益生菌的生存能力,提供可发酵纤维的来源,并作为一般的益生元。一种由GOS和一种双菌株益生菌(L. helveticus和B. longum)可使抑郁评分降低,并对轻度至中度抑郁症患者的色氨酸信号传导产生积极影响。在一项包含多种益生菌和益生元的合生素的随机对照试验中,帕金森病患者的功能性胃肠道症状得到改善。一项研究在PTSD队列中显示了发酵大豆饮料的积极效果,目前还没有足够的证据表明其在PTSD患者的肠道-大脑轴信号有改善作用。最近的一项初步研究显示,一种合生素(婴儿双歧杆菌加寡糖)在改善一些与ASD和肠道共病相关方面显示一些前景。
后生元
后生元是细菌发酵的代谢物,包括生物活性物质如SCFAs。我们还考虑了细菌与宿主相互作用的后果,以及由此产生的生物活性物质作为后生元,如肠道多肽。关于生物活性物质的使用及其对大脑健康的影响的研究有限,但是,肠道微生物群和短链脂肪酸对代谢特性和疾病的影响最近已有报告。关于脑健康,临床研究已经描述了SCFA组合(醋酸、丙酸和丁酸的混合物)对经历社会心理应激的小鼠具有抗焦虑作用。给大鼠服用丙酸会导致类似自闭症的表型。在一项人体干预研究中,一种菊粉丙烯酸钠酯增加了结肠丙烯酸钠的产生,通过功能性核磁共振成像来确定对食物图片评价任务的反应显示,使用补充剂后,纹状体中的预期奖励反应减少了。因此,通过补充这些生物活性物质,可以靶向行为是合理的。
肠肽在影响行为和压力、焦虑和抑郁中都有明确的作用。虽然由于技术问题可能难以直接使用肠道肽作为肠-脑轴信号的干预,但靶向特定微生物以调节特定的肠道肽可能是一种有用的心理生物疗法。
副益生菌或不能存活的益生菌,例如,也可以包含在一类后生元,它们包含结构组件可能发挥生物活性的主人,现在有一些人类研究与益生菌-肠-脑轴有关的补充。通过12周的副益生菌CP2305的干预,医学院学生因大学考试的压力得到了缓解,女学生的状态焦虑分数有所改善,基础皮质醇分泌量也有所改善,睡眠指标也有所改善。在临床前研究中,一些益生菌已经被描述抗抑郁和抗焦虑作用,副干酪乳杆菌PS23有益于皮质酮诱导的抑郁表型,逆转海马和前额皮质多巴胺水平的下降。热杀菌副益生菌比益生菌(活的生物疗法)有明显的市场优势,因为它可以延长保质期,而且可能在安全性方面也有提高。然而,并非所有的益生菌菌株都能作为热杀灭制剂有效,正如在一项植物乳杆菌菌株对改善小鼠焦虑样行为的干预研究的结果。
发酵食品和饮食
发酵食品长期以来一直是传统文化饮食的主要组成部分。事实上,这就是埃利·麦特奇尼科夫最初在保加利亚人群中描述了益生菌的方式。发酵食品含有益生菌、益生元和细菌产生的生物活性物质。发酵过程中最常见的两种菌株包括乳杆菌delbreuckii亚种,保加利亚和嗜热链球菌。在乳制品中,生产乳酸常用是双歧杆菌和乳酸菌。使用发酵食品干预人类的研究有限;然而,有证据表明焦虑和情绪得分有所改善。发酵牛奶饮料被发现对情绪处理和压力有积极的好处,而其他人没有发现肠道-大脑轴的好处。
地中海饮食对心理健康有好处。一项针对女性的大型数据研究发现,更健康的饮食模式与更好的总体健康评分和焦虑和抑郁结果的发生率降低相关。一项对22项研究的荟萃分析也显示,地中海饮食增加,抑郁症和认知障碍的风险降低,包括患AD的风险。进一步的荟萃分析证实了这些发现,并描述了地中海饮食的好处,以及西式饮食的有害影响。最近发表的一项对14项观察性研究进行了荟萃分析,发现抑郁风险与坚持地中海饮食之间没有显著关联,但确实发现了与抑郁风险之间的关联。有必要对富含潜在精神生物制剂的饮食的益处进行更多的前瞻性饮食研究,以充分阐明压力、焦虑和抑郁结果的潜在益处。第一个这样的研究,SMILES试验,描述了饮食改善干预在中度至重度抑郁症队列中的明显益处,经济评估表明,这可能是一个潜在的成本效益更大的实施选择。在一组被诊断为抑郁和/或焦虑的患者中,饮食改善也导致了焦虑和抑郁得分的提高,这组患者经过了12周的饮食建议干预,包括增加水果和蔬菜的摄入量和减少分量等积极的变化。一项进一步的研究还发现,在接受补充鱼油的地中海饮食干预后,一组被诊断或自我报告的抑郁症患者的抑郁评分和生活质量评分均有所改善。最近一项关于改善抑郁和焦虑饮食的荟萃分析发现,有证据表明,改善抑郁效果有益,但改善焦虑不显著。
显然,在精神病人群中利用健康饮食的好处的兴趣越来越大。地中海饮食包括许多富含微生物的元素,特别是益生元。这种饮食与发酵食品和后生物制剂的结合,可能产生一种具有特别有益的肠道-脑轴信号。这种神经生物制剂饮食值得研究,因为它在缓解压力、焦虑和抑郁症状方面有潜在的好处。
药物和微生物组
虽然抗生素治疗显然对肠道菌群有深远的影响,但最近的一些研究强调了其他药物在肠道菌群研究中的潜在混杂效应。特别地,一项关于T2DM(2型糖尿病)的研究确定,二甲双胍(一种常用的抗糖尿病药物)是导致T2DM患者肠道菌群改变的主要原因,此前有报道称这是由该疾病引起的。作者确定,当考虑到药物的混杂效应时,存在一个特定的2型糖尿病肠道微生物群特征,而二甲双胍的有益效应实际上可以通过微生物群介导。此后,有几项研究描述了可能改变肠道菌群的药物,质子泵抑制剂(PPIs)对肠道微生物群有良好的影响。此外,多种非抗生素药物已被确定具有抗菌特性,包括几种精神药物,这些药物可能通过改变微生物谱或激活微生物-肠道-大脑轴信号发挥其有利或不利作用。事实上,最近发表的一项小型研究表明,与1周的基线样本相比,住院并接受选择性5 -羟色胺再摄取抑制剂抗抑郁药艾司西酞普兰治疗6周的抑郁症患者群的微生物α多样性增加。然而,值得注意的是,由于道德上的考虑,在这项针对抑郁症患者的研究中没有安慰剂组,医院饮食的影响可能是一个混杂因素。关于帕金森病,肠道微生物也被确定导致左旋多巴的部分分解。总的来说,越来越明显的是,在研究药物在体内的作用机制以及与药物的有利或不利影响有关的任何研究中,都需要考虑肠道微生物群。肠道菌群可以在许多情况下提供新的治疗选择,或者在其他情况下减小代谢副作用,如抗精神病药物,肠道菌群甚至可能导致某些药物的疗效降低。
筛选微生物组中的神经微生物
筛选微生物组以确定潜在的神经微生物与传统药物筛选非常不同(图3)。新鲜粪便取样,结合在特定琼脂培养基中培养的细菌。这些粪便样本可以从正常被试中提取,但针对那些压力相关的个体可能特别有益,以及针对神经和精神障碍患者中含量较低的菌株。然后通过基因组测序确定菌株。虽然某些属的菌株,如乳酸菌和双歧杆菌,在一些地区已被认可为安全状态,但其他新的益生菌在被批准使用前需要通过广泛的分析。在欧盟,为了满足欧洲食品安全局(European Food Safety Authority)的合格安全推定(Qualified hypothesis of Safety),微生物必须满足某些标准,包括其分类的识别、其安全性的确立、致病特性的排除和其预期用途的明确定义。
图3筛选潜在的心理生物疗法。对心理生物的探索是多模式的,首先是识别感兴趣的菌株,然后是一系列测试,以确定是否对微生物群-肠-脑轴信号传导产生积极影响。
一旦菌株被选择,除了体外细胞测试外,它们还可以用于一系列的分析,如酶分析,其中感兴趣的细胞与不同浓度的益生菌候选细胞孵育。根据感兴趣的细胞类型,可以监测细胞的生长形态,以及抗炎细胞因子和其他生物活性物质如SCFAs、神经递质和激素的产生。肠道内的G蛋白偶联受体(GPCRs)可以被微生物产生的生物活性物直接靶向,经典药理学方法可以用来确定微生物对GPCRs的生物活性作用。如果一种候选益生菌在这些因素中显示出益处,那么该益生菌就可以用于临床前体内试验,并进行进一步的安全性分析。关于何时提供补充剂,无论是在早期,青春期,还是成年,在压力源之前或期间,都需要仔细考虑。进一步的行为测试通常用于阐明是否有抗焦虑或抗抑郁的作用。
观点和结论
对于那些从事神经药理学和神经毒理学工作的人来说,需要对微生物群进行大量的反思。我们已经从把重点放在单个细菌菌株作为病原体,转而强调培养整个微生物群落,以免它们成为一个病原体。有许多挑战传统在改变肠道微生物群中提到许多中枢神经系统疾病的症状表现可能有因果作用,许多药物用于治疗这些疾病可能危害或维持我们的肠道微生物的多样性。了解这些基本规则,以及它们对药代动力学和药效学的影响,是一个大项目,需要更大的实验支持。然而,药物开发工作将把这一知识纳入到流程中,筛查人为指导的药物的抗菌特性可能很快就会成为常规。
当然,直接针对肠道微生物群很有潜力,通过在肠道内初始作用位点,产生新一代具有优越安全性的中枢神经系统疾病治疗方案。支持良好的心理健康和适应力增强,可以很容易地与神经微生物的生活方式相协调,这也有利于我们的总体健康。然而,越来越明显的是,微生物-肠道-大脑轴信号的靶向改变,代表了一个令人兴奋的治疗机会,辅助治疗许多心理和精神疾病。挖掘肠道微生物群中潜在的精神疾病相关的微生物可能为开发这些新的干预措施铺平道路。